题目内容
已知:C+CO2?2CO,正反应为吸热反应,达到平衡后,改变下列条件,能使平衡常数增大的是( )
| A、升温 | B、加压 |
| C、降温 | D、使用催化剂 |
考点:化学平衡常数的含义
专题:化学平衡专题
分析:在一定温度下,当可逆反应达平衡时,生成物浓度方次的乘积与反应物浓度方次的乘积之比是一个常数,这个常数就是平衡常数,固体或纯液体浓度是一个常数,不表现在平衡常数公式中,平衡常数只与温度有关.
解答:
解:平衡常数只与温度有关,反应C+CO2?2CO△H>0,平衡常数K=
,升温,平衡正向移动,平衡常数K增大,故选A.
| c2(CO) |
| c(CO2) |
点评:本题考查平衡常数的影响因素,固体或纯液体浓度是一个常数,不表现在平衡常数公式中,难度不大,注意根据平衡移动原理分析解答.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
在相同温度和体积均为1L的三个密闭容器中,保持温度和容积不变,以三种不同的投料方式进行反应,平衡时有关数据如下(已知相同条件下2SO2(g)+O2(g)?2SO3(g)△H=-196kJ/mol),下列说法正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 起始投入量 | 2mol SO2和1mol O2 | 2mol SO3 | 2mol SO2和2mol O2 |
| 反应放出或吸收的 热量(kJ) | Q1 | Q2 | Q3 |
| 平衡时SO3的物质的量 | n1 | n2 | n3 |
| 平衡转化率 | |||
| 平衡时压强 | p1 | p2 | p3 |
| A、Q1=Q2>Q3 |
| B、n2>n1>n3 |
| C、a1+a2=1 |
| D、p1>p2>p3 |
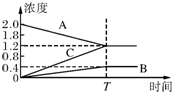 如图的曲线是800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是平衡的时间,能以此曲线表示的反应是( )
如图的曲线是800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是平衡的时间,能以此曲线表示的反应是( )| A、2A?B+3C |
| B、B+3C?2A |
| C、A+C?B |
| D、B?A+C |
在一定条件下,反应N2+3H2?2NH3,在2L密闭容器中进行,5min内氨的物质的量增加了1mol,则有关该反应的速率正确的是( )
| A、υ(H2)=0.15 mol/(L?min) |
| B、υ(N2)=0.2mol/(L?min) |
| C、υ(N2)=0.1 mol/(L?min) |
| D、υ (NH3)=0.2mol/(L?min) |
下列电池工作时,O2在正极放电的是( )
 |  |  |  |
| A.甲醇燃料电池 | B.镍镉电池 | C.锌锰电池 | D.铅蓄电池 |
| A、A | B、B | C、C | D、D |
下列各反应中,水作为还原剂的是( )
| A、2H2+O2=2H2O |
| B、SO3+H2O=H2SO4 |
| C、2F2+2H2O=4HF+O2 |
| D、2Na+2H2O=2NaOH+H2↑ |
铝制器皿能够盛放的物质是( )
| A、KOH溶液 | B、NaOH溶液 |
| C、浓硫酸 | D、稀硝酸 |
下列说法不正确的是( )
| A、要想使AlCl3溶液中的Al3+几乎全部沉淀出来,可以加入过量的氨水 |
| B、向FeCl2溶液中加入氨水,最终会看到红褐色沉淀 |
| C、保存硫酸亚铁溶液时常在其中加颗铁钉 |
| D、氢氧化钠、纯碱溶液要存放在带磨砂玻璃塞的试剂瓶中 |