题目内容
20.常温下将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:| 实验编号 | c(HA)/mol•L-1 | c(NaOH)/mol•L-1 | 混合后溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | b | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH<7 |
| 丁 | 0.1 | 0.1 | pH=c |
| A. | 甲中:若a=7,则HA是强酸 | |
| B. | 乙中:若b≠0.2,则c(A-)≠c(Na+) | |
| C. | 丙中:若HA是弱酸,则c(A-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 丁中:若c=9,则c(OH-)-c(HA)=10-9mol•L-1 |
分析 A.若a=7,说明反应生成的NaA为强酸强碱盐;
B.溶液中一定满足电荷守恒,根据电荷守恒判断;
C.丙反应后溶液呈酸性,则c(H+)>c(OH-),结合电荷守恒判断各离子浓度大小;
D.pH=9的NaA溶液中c(H+)=10-9mol/L,根据NaA溶液的质子守恒分析.
解答 解:A.甲中若a=7,反应后溶液呈中性,说明反应生成的NaA为强酸强碱盐,则HA是强酸,故A正确;
B.乙中反应后溶液的pH=7,呈中性,则c(H+)=c(OH-),根据电荷守恒可知:c(A-)=c(Na+),故B错误;
C.丙中若HA是弱酸,反应后溶液呈酸性,c(H+)>c(OH-),根据电荷守恒可知c(A-)>c(Na+),溶液中离子浓度大小为:c(A-)>c(Na+)>c(H+)>c(OH-),故C正确;
D.pH=9的NaA溶液中c(H+)=10-9mol/L,根据质子守恒c(OH-)=c(AH)+c(H+)可知:c(H+)=c(OH-)-c(HA)=10-9mol/L,故D正确;
故选B.
点评 本题考查了酸碱混合的定性判断、离子浓度大小比较,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答结构,注意掌握酸碱混合的定性判断方法,能够根据盐的水解原理、电荷守恒等知识正确判断各离子浓度大小.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列物质在氯气中燃烧时,能产生白色烟雾的是( )
| A. | 红磷 | B. | 铜丝 | C. | 氢气 | D. | 金属钠 |
11.某有机物X能发生水解反应,水解产物为Y和Z.同温同压下,相同质量的Y和Z的蒸气所占体积相同,化合物X可能是( )
| A. | 乙酸丁酯 | B. | 甲酸乙酯 | C. | 乙酸甲酯 | D. | 乙酸乙酯 |
15.常温下,浓度为0.05mol•L-1的H2SO4溶液其PH值为( )
| A. | 2 | B. | 13 | C. | 1 | D. | 1.3 |
9.O2F2可以发生反应:H2S+4O2F2═SF6+2HF+4O2,下列说法正确的是( )
| A. | 氧化剂与还原剂的物质的量之比为1:4 | |
| B. | O2F2既是氧化剂又是还原剂 | |
| C. | 若生成4.48 L HF,则转移0.8 mol电子 | |
| D. | 氧气是还原产物 |
10.某学生配制的1mol/L-1的NaOH溶液,实际浓度偏高的原因可能是( )
| A. | 洗净的容量瓶中残留少量的蒸馏水 | B. | 溶解NaOH的烧杯未洗净 | ||
| C. | 称量NaOH时使用称量纸 | D. | 定容时俯视刻度线 |
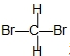 和
和 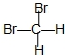
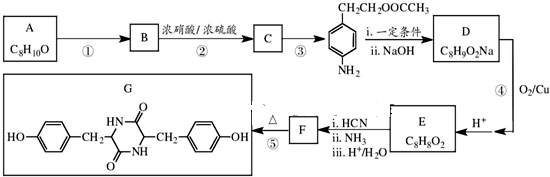
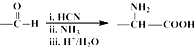 ,NO2$\stackrel{Fe?HCl}{→}$NH2
,NO2$\stackrel{Fe?HCl}{→}$NH2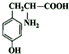 .
.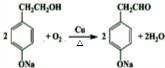 .
.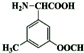 .
.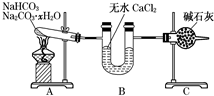 NaHCO3和Na2CO3•xH2O的混合物,为了测定x值,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量).
NaHCO3和Na2CO3•xH2O的混合物,为了测定x值,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量).