题目内容
12.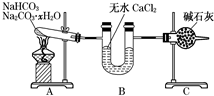 NaHCO3和Na2CO3•xH2O的混合物,为了测定x值,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量).
NaHCO3和Na2CO3•xH2O的混合物,为了测定x值,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量).(1)A装置的作用是使NaHCO3分解,使Na2CO3•H2O失水.
(2)B装置的作用是吸收反应中生成的水.
(3)C装置的作用是吸收反应中生成的CO2.
(4)若在装置A的试管中装入NaHCO3和Na2CO3•xH2O的混合物3.7g,用酒精灯加热到反应完全,此时B管增重1.89g,C管增重0.22g,则x的值为10.
(5)该装置还不是很完善,可能使测定结果偏小,应如何改进在C装置后再加一个装有碱石灰的U形管.为什么?
分析 (1)在加热的条件下碳酸氢钠易分解生成碳酸钠、水和CO2,而碳酸钠晶体也易失去结晶水,所以A装置的作用是加热,使NaHCO3分解,使Na2CO3•H2O失水;
(2)无水氯化钙能吸收水蒸气,通过称量反应前后的质量可以得出水蒸气的质量,因此B装置的作用是吸收反应中生成的水;
(3)由于反应中还有CO2生成,而碱石灰可以吸收CO2,因此通过称量反应前后的质量,可以得出CO2的质量,所以C装置的作用是吸收反应中生成的CO2;
(4)用酒精灯加热到反应完全,此时B管增重1.89g,C管增重0.22 g,这说明反应中生成的水蒸气质量=1.89g,CO2质量=0.22g,物质的量分别是$\frac{1.89g}{18g/mol}$=0.105mol、$\frac{0.22g}{44g/mol}$=0.005mol.根据反应的方程式2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑可知,该反应中生成的CO2就是0.005mol,则碳酸氢钠的物质的量是0.005mol×2=0.01mol,反应中生成的水是0.005mol.则碳酸钠在反应中失去的水的物质的量=0.105mol-0.005mol=0.100mol.碳酸氢钠的质量=0.01mol×84g/mol=0.84g,计算得到碳酸钠质量分数;
(5)由于空气中也含有CO2和水蒸气,也能被C装置的中碱石灰吸收,从而导致C管增重偏高,因此测量值偏低;所以改进的措施为在C装置后再加一个装有碱石灰的U形管;为了防止空气中的CO2和H2O被C装置的中的碱石灰吸收.
解答 解:(1)在加热的条件下碳酸氢钠易分解生成碳酸钠、水和CO2,而碳酸钠晶体也易失去结晶水,所以A装置的作用是加热,使NaHCO3分解,使Na2CO3•H2O失水;
故答案为:使NaHCO3分解,使Na2CO3•H2O失水;
(2)无水氯化钙能吸收水蒸气,通过称量反应前后的质量可以得出水蒸气的质量,因此B装置的作用是吸收反应中生成的水;
故答案为:吸收反应中生成的水;
(3)由于反应中还有CO2生成,而碱石灰可以吸收CO2,因此通过称量反应前后的质量,可以得出CO2的质量,所以C装置的作用是吸收反应中生成的CO2;
故答案为:吸收反应中生成的CO2;
(4)用酒精灯加热到反应完全,此时B管增重1.89g,C管增重0.22 g,这说明反应中生成的水蒸气质量=1.89g,CO2质量=0.22g,物质的量分别是$\frac{1.89g}{18g/mol}$=0.105mol、$\frac{0.22g}{44g/mol}$=0.005mol.根据反应的方程式2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑可知,该反应中生成的CO2就是0.005mol,则碳酸氢钠的物质的量是0.005mol×2=0.01mol,反应中生成的水是0.005mol.则碳酸钠在反应中失去的水的物质的量=0.105mol-0.005mol=0.100mol.碳酸氢钠的质量=0.01mol×84g/mol=0.84g,则样品中碳酸钠晶体的质量=3.7g-0.84g=2.86g.则$\frac{2.86g}{(106+18x)g/mol}$×x=0.1mol,解得x=10;
故答案为:10;
(5)由于空气中也含有CO2和水蒸气,也能被C装置的中碱石灰吸收,从而导致C管增重偏高,因此测量值偏低;所以改进的措施为在C装置后再加一个装有碱石灰的U形管;为了防止空气中的CO2和H2O被C装置的中的碱石灰吸收;
故答案为:在C装置后再加一个装有碱石灰的U形管;为了防止空气中的CO2和H2O被C装置的中的碱石灰吸收.
点评 本题考查了物质组成的实验探究和实验测定方法分析,质量分数计算应用,掌握实验基本操作和物质性质是关键,题目难度中等.

(1)提出假设:
假设1:该固体物质是FeCl2
假设2:该固体物质是FeCl3
假设3:该固体物质是FeCl3和FeCl2的混合物
(2)设计方案:
取少量固体物质于烧杯中,加适量水溶解,得到溶液A,然后取两份A溶液分别进行实验,实验现象与结论如下表,请将表中现象和结论补充完整.
| 实验方法 | 实验现象 | 结 论 |
| 在溶液中加KSCN溶液 | 溶液变红色 | 固体物质中有FeCl3 |
| 在KMnO4溶液中加少量A溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含FeCl2 |
(4)为进一步探究FeCl3溶液的性质,他又利用A溶液做了如下一些实验,其中明显错误的一项是D
A.将A溶液滴入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔现象
B.铜片放入在A溶液中,铜片会被溶蚀
C.在A溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.在A溶液中加入碘化钾淀粉溶液无明显现象.
| 实验编号 | c(HA)/mol•L-1 | c(NaOH)/mol•L-1 | 混合后溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | b | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH<7 |
| 丁 | 0.1 | 0.1 | pH=c |
| A. | 甲中:若a=7,则HA是强酸 | |
| B. | 乙中:若b≠0.2,则c(A-)≠c(Na+) | |
| C. | 丙中:若HA是弱酸,则c(A-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 丁中:若c=9,则c(OH-)-c(HA)=10-9mol•L-1 |
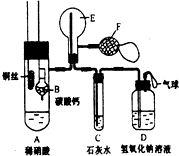 为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球. 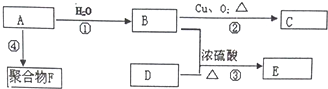
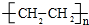 .
.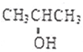 化学性质与B相似,试写出
化学性质与B相似,试写出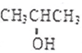 在有催化剂和加热条件下与O2反应的化学方程式:2
在有催化剂和加热条件下与O2反应的化学方程式:2