题目内容
5.乙醇是一种可再生能源,可用它来制成燃料电池(如图),试写出其负极的电极反应式C2H5OH-12e-+16OH-=2CO32-+11H2O.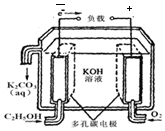
分析 原电池中负极上燃料失电子,碱性条件下,CH3CH2OH反应生成碳酸根离子,据此书写.
解答 解:原电池中负极上燃料失电子,碱性条件下,CH3CH2OH反应生成碳酸根离子,电极反应式为C2H5OH-12e-+16OH-=2CO32-+11H2O,
故答案为:C2H5OH-12e-+16OH-=2CO32-+11H2O.
点评 本题考查了燃料电池的电极反应式书写,难度不大,注意电解质溶液的酸碱性对产物的影响.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
14.下列反应的离子方程式书写不正确的是( )
| A. | 1.5mol/L100mL的FeI2溶液中,通入少量Cl2:2I-+Cl2=I2+2Cl- | |
| B. | 饱和的碳酸钠溶液中滴加少量稀盐酸:CO32-+H+=HCO3- | |
| C. | 氯化铝溶液中加入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| D. | 次氯酸钠溶液中通入少量的SO2气体:2ClO-+SO2+H2O=SO32-+2HClO |
16.下列离子方程式书写正确的是( )
| A. | 铜与氯化铁溶液反应:2Fe3++Cu═2Fe2++Cu2+ | |
| B. | 锌粒与稀硝酸反应:Zn+2 H+═Zn2++H2↑ | |
| C. | 氯气与水反应:H2O+Cl2═2H++Cl-+ClO- | |
| D. | 工业制漂白粉:Cl2+2OH-═Cl-+ClO-+H2O |
13.下列离子方程式书写正确的是( )
| A. | Cl2与H2O反应:Cl2+H2O?2H++Clˉ+ClOˉ | |
| B. | 碳酸钡与稀硫酸反应:CO32-+2H+=CO2↑+H2O | |
| C. | CuSO4溶液与少量稀氨水反应:Cu2++2OH-=Cu(OH)2↓ | |
| D. | 铁和氯化铁溶液反应:2Fe3++Fe=3Fe2+ |
20.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 常温下,22.4LNH3与氧气完全反应生成NO时,转移的电子数小于5NA | |
| B. | 在1mol重甲基(-CD3)中含有的电子数为9NA | |
| C. | 在电解食盐水的实验中,若电解后溶液总体积为1L,阴极析出的气体的分子数为0.5NA,电解后溶液的pH为12 | |
| D. | 一定条件下3mol SO2和1 molO2 混合在密闭容器中充分反应后的分子总数为3NA |
11.下列实验设计正确的是( )
| A. | 将SO2通入溴水中证明SO2具有漂白性 | |
| B. | 用向上排空气法收集铜粉与稀硝酸反应产生的NO | |
| C. | 将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 | |
| D. | 将乙烯通入KMnO4酸性溶液证明乙烯具有还原性 |
8.二氧化碳是引起“温室效应”的主要物质.高效利用能源,能够减少二氧化碳的排放.
I.在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2,发生的反应为CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
①不能说明该反应已达平衡状态的是D.(填编号)
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时消耗0.4mol H2O
D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②从0min到10min,v(H2)=0.075 mol•L-1•min-1.
③下列措施中不能使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大的是C(填编号).
A.降低温度 B.将H2O(g)从体系中分离
C.恒温恒容下充入He(g) D.恒温恒容再充入2mol CO2和3mol H2
④计算该温度下此反应的平衡常数K=0.20 L2/mol2_(保留两位有效数字).
II.为进一步探究CO2与NaCN溶液反应的产物,查得数据如下:
①25℃时,测得HCN和NaCN的混合溶液的pH=11,则c(HCN)/c(CN-)=$\frac{1}{49}$(可用分数表示).
②向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:CN-+CO2+H2O=HCN+HCO3-.
III.(1)有一种利用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=-a kJ•mol-1;
CH3OH(g)═CH3OH(l)△H=-b kJ•mol-1;
2H2(g)+O2(g)═2H2O(l)△H=-c kJ•mol-1;
则表示CH3OH(l) 燃烧热的热化学方程式为CH3OH(l)+3/2O2(g)═CO2(g)+2H2O(l)△H=-($\frac{3}{2}$c-a-b) kJ•mol-1.
(2)某甲醇燃料电池原理如图2所示.
①M区发生反应的电极反应式为CH3OH-6e-+H2O=CO2+6H+.
②用上述电池做电源,用图3装置电解饱和食盐水(电极均为惰性电极),假设溶液体积为300mL(体积变化忽略),当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为0.16g.

I.在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2,发生的反应为CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
①不能说明该反应已达平衡状态的是D.(填编号)
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时消耗0.4mol H2O
D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②从0min到10min,v(H2)=0.075 mol•L-1•min-1.
③下列措施中不能使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大的是C(填编号).
A.降低温度 B.将H2O(g)从体系中分离
C.恒温恒容下充入He(g) D.恒温恒容再充入2mol CO2和3mol H2
④计算该温度下此反应的平衡常数K=0.20 L2/mol2_(保留两位有效数字).
II.为进一步探究CO2与NaCN溶液反应的产物,查得数据如下:
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
②向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:CN-+CO2+H2O=HCN+HCO3-.
III.(1)有一种利用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=-a kJ•mol-1;
CH3OH(g)═CH3OH(l)△H=-b kJ•mol-1;
2H2(g)+O2(g)═2H2O(l)△H=-c kJ•mol-1;
则表示CH3OH(l) 燃烧热的热化学方程式为CH3OH(l)+3/2O2(g)═CO2(g)+2H2O(l)△H=-($\frac{3}{2}$c-a-b) kJ•mol-1.
(2)某甲醇燃料电池原理如图2所示.
①M区发生反应的电极反应式为CH3OH-6e-+H2O=CO2+6H+.
②用上述电池做电源,用图3装置电解饱和食盐水(电极均为惰性电极),假设溶液体积为300mL(体积变化忽略),当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为0.16g.

12.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,2.24 L 乙醇中含有的碳原子数为0.2NA | |
| B. | 0.5 mol•L-1 NaOH溶液中,含Na+数目为0.5NA | |
| C. | C60和石墨的混合物共1.8 g,含碳原子数目为0.15NA | |
| D. | 常温常压下,1.12LCO2与足量的Na2O2反应转移的电子数目为0.05NA |
 NO、NO2 和CO均为大气污染物,对其治理备受关注.请回答下列问题:
NO、NO2 和CO均为大气污染物,对其治理备受关注.请回答下列问题: