题目内容
7.用可溶性钡盐检验SO42-的存在时,先向待测液中加入盐酸,再加可溶性钡盐.先加盐酸的作用是( )| A. | 形成的沉淀纯度更高 | |
| B. | 形成较多的白色沉淀 | |
| C. | 排除CO32-、SO32- 和Ag+等离子的干扰 | |
| D. | 盐酸加与不加对实验结果不影响 |
分析 可溶性钡盐检验SO42-,生成硫酸钡沉淀,若含银离子、碳酸根离子也可生成白色沉淀,从而干扰硫酸根离子的检验,以此来解答.
解答 解:用可溶性钡盐检验SO42-的存在时,先向待测液中加入盐酸,先加盐酸的作用排除CO32-、SO32- 和Ag+等离子的干扰,观察到无现象后,再加可溶性钡盐,若生成白色沉淀可说明存在SO42-,反之不含,与A、B、D中因素无关,
故选C.
点评 本题考查常见离子的检验,为高频考点,把握离子检验的试剂、现象、结论为解答的关键,侧重分析与应用能力的考查,注意排除干扰离子的影响,题目难度不大.

练习册系列答案
相关题目
1.中和0.45g实验式为CH2O的一元羧酸用去0.1mol•L-1NaOH溶液50.00mL,则该酸的分子式应为( )
| A. | C2H4O2 | B. | C3H6O3 | C. | C4H6O4 | D. | C6H12O6 |
15.NA表示阿伏加德罗常数,以下说法正确的是( )
| A. | 18g金属铝由原子变为离子时失去的电子数为NA | |
| B. | 在通常条件下,1mol氩气含有的原子数为2NA | |
| C. | 在标准状况下,2.24 L氨气所含的电子总数约为NA | |
| D. | 含有NA个原子的镁在足量的二氧化碳气体中充分燃烧生成固体的质量为40g |
2.下列离子方程式正确的是( )
| A. | 过氧化钠与水反应:2O22-+2H2O═O2↑+4OH- | |
| B. | 向碳酸氢镁溶液中加入过量的澄清石灰水:Mg2++2HCO3-+2Ca2++4OH-═Mg(OH)2↓+2CaCO3↓+2H2O | |
| C. | 向明矾[KAl(SO4)2•12H2O]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| D. | 次氯酸钠与Fe(OH)3在碱性溶液中反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ |
12.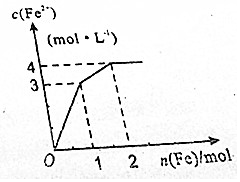 在Fe2(SO4)3和CuSO4的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示.若不考虑溶液体积变化,下列说法错误的是( )
在Fe2(SO4)3和CuSO4的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示.若不考虑溶液体积变化,下列说法错误的是( )
 在Fe2(SO4)3和CuSO4的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示.若不考虑溶液体积变化,下列说法错误的是( )
在Fe2(SO4)3和CuSO4的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示.若不考虑溶液体积变化,下列说法错误的是( )| A. | 溶液体积为2L | B. | n(SO42-)=4mol | ||
| C. | c【Fe2(SO4)3】:c【CuSO4】=1:1 | D. | 氧化性:Fe3+>Cu2+>Fe2+ |
16.700℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2,发生如下反应:CO(g)+2H2(g)?CH3OH(g),反应过程中测定的部分数据见表:下列说法正确的是( )
| 反应时间/min | n(CO)/mol | n(H2)/mol |
| 0 | 0.60 | 1.20 |
| 20 | 0.20 | |
| 30 | 0.40 |
| A. | 反应在20 min内的平均速率为v(H2)=0.04 mol•L-1•min-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(CH3OH)=0.15 mol•L-1,则反应的△H<0 | |
| C. | 保持其他条件不变,再向平衡体系中同时通入0.20 mol CO、0.20 mol H2、0.20 mol CH3OH,达到新平衡前v(正)>v(逆) | |
| D. | 相同温度下,若起始时向容器中充入1.0 mol CH3OH,达到平衡时CH3OH转化率大于$\frac{1}{3}$ |
17.现在NaOH、Na2CO3、Ba(OH)2三种无色溶液,选用一种试剂就能把它们鉴别出来,这种试剂是( )
| A. | HCl | B. | Ca(OH)2 | C. | H2SO4 | D. | NaHCO3 |