题目内容
1.中和0.45g实验式为CH2O的一元羧酸用去0.1mol•L-1NaOH溶液50.00mL,则该酸的分子式应为( )| A. | C2H4O2 | B. | C3H6O3 | C. | C4H6O4 | D. | C6H12O6 |
分析 该酸为一元羧酸,故与NaOH反应时1:1,n(NaOH)=0.05L×0.1mol•L-1=0.005mol,则n(一元羧酸)=0.005mol,M=$\frac{m}{n}$=$\frac{0.45g}{0.005mol}$=90g/mol,设一元羧为(CH2O)n,则30n=90,n=3,故一元羧的分子式为C3H6O3,据此进行分析.
解答 解:因为该酸为一元羧酸,故与NaOH反应时1:1,n(NaOH)=0.05L×0.1mol•L-1=0.005mol,则n(一元羧酸)=0.005mol,M=$\frac{m}{n}$=$\frac{0.45g}{0.005mol}$=90g/mol,设一元羧为(CH2O)n,则30n=90,n=3,故一元羧的分子式为C3H6O3,
故选B.
点评 注意把握有机物的物质的性质,并结合相对分子质量确定分子式,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.硼是第IIIA族元素,单质硼在加热条件下能与多种非金属反应.某同学欲利用氯气和单质硼反应制备三氯化硼.已知BCl3的沸点为12.5℃,熔点为-107.3℃,遇水剧烈反应.
(1)选用如图所示的装置(可以重复选用)进行实验,装置依次连接的合理顺序为ABDCEDF.
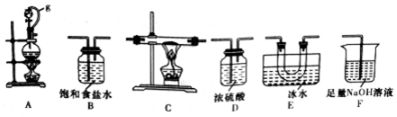
(2)图中g管的作用是保持气压平衡,便于分液漏斗中的液体流入蒸馏烧瓶,装置E的作用是冷凝并收集BCl3.
(3)开始实验时,先点燃A(填“A”或“B”)处的酒精灯.
(4)请写出BCl3遇水变质的化学方程式BCl3+3H2O=H3BO3+3HCl.
(5)硼酸是一元弱酸,其钠盐化学式为Na,则硼酸在水中电离方程式是H3BO3+H2O?[B(OH)4]-+H+.
(6)实验完成后,某同学向F (溶液中含有0.05mol/LNaC1 0、0.05mol/LNaCl、0.1mol/L NaOH)中滴加品红溶液,发现溶液褪色.现设计实验探究溶液褪色的原因,请将表中数据补充完整,完成实验方案.
x=4.0,结论:NaClO使品红溶液褪色,溶液碱性越强褪色越慢.
(1)选用如图所示的装置(可以重复选用)进行实验,装置依次连接的合理顺序为ABDCEDF.

(2)图中g管的作用是保持气压平衡,便于分液漏斗中的液体流入蒸馏烧瓶,装置E的作用是冷凝并收集BCl3.
(3)开始实验时,先点燃A(填“A”或“B”)处的酒精灯.
(4)请写出BCl3遇水变质的化学方程式BCl3+3H2O=H3BO3+3HCl.
(5)硼酸是一元弱酸,其钠盐化学式为Na,则硼酸在水中电离方程式是H3BO3+H2O?[B(OH)4]-+H+.
(6)实验完成后,某同学向F (溶液中含有0.05mol/LNaC1 0、0.05mol/LNaCl、0.1mol/L NaOH)中滴加品红溶液,发现溶液褪色.现设计实验探究溶液褪色的原因,请将表中数据补充完整,完成实验方案.
| 实验序号 | 0.1mol/LNaClO溶液/mL | 0.1mol/LNaCl溶液/mL | 0.2mol/LNaOH溶液/mL | H2O/mL | 品红溶液 | 现象 |
| ① | 4.0 | 0 | 0 | x | 3滴 | 较快褪色 |
| ② | 0 | 4.0 | 4.0 | 0 | 3滴 | 不褪色 |
| ③ | 4.0 | 0 | 4.0 | 0 | 3滴 | 缓慢褪色 |
16.茚满( )可用作航空燃料的防震剂、橡胶工业防震剂等.1mol茚满与氧气、氢气反应,最多消耗氧气和氢气的物质的量之比是( )
)可用作航空燃料的防震剂、橡胶工业防震剂等.1mol茚满与氧气、氢气反应,最多消耗氧气和氢气的物质的量之比是( )
 )可用作航空燃料的防震剂、橡胶工业防震剂等.1mol茚满与氧气、氢气反应,最多消耗氧气和氢气的物质的量之比是( )
)可用作航空燃料的防震剂、橡胶工业防震剂等.1mol茚满与氧气、氢气反应,最多消耗氧气和氢气的物质的量之比是( )| A. | 23:3 | B. | 3:23 | C. | 23:6 | D. | 6:23 |
2.下列电离方程式书写不正确的是( )
| A. | 2H2O?H3O++OH- | B. | H2S?H++HS- | C. | NaHS=Na++HS- | D. | HCO3-=H++CO32- |
9.下列物质中可以作为混凝剂的是( )
| A. | 氯化钠 | B. | 氯气 | C. | 小苏打 | D. | 明矾 |
7.用可溶性钡盐检验SO42-的存在时,先向待测液中加入盐酸,再加可溶性钡盐.先加盐酸的作用是( )
| A. | 形成的沉淀纯度更高 | |
| B. | 形成较多的白色沉淀 | |
| C. | 排除CO32-、SO32- 和Ag+等离子的干扰 | |
| D. | 盐酸加与不加对实验结果不影响 |
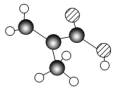 某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键). .
.