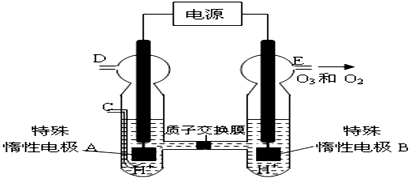
题目内容
17.现在NaOH、Na2CO3、Ba(OH)2三种无色溶液,选用一种试剂就能把它们鉴别出来,这种试剂是( )| A. | HCl | B. | Ca(OH)2 | C. | H2SO4 | D. | NaHCO3 |
分析 NaOH、Na2CO3、Ba(OH)2三种无色溶液均显碱性,分别与硫酸反应的现象为:无现象、无色气体、白色沉淀,以此来解答.
解答 解:A.HCl不能检验NaOH、Ba(OH)2,故A不选;
B.Ca(OH)2不能检验NaOH、Ba(OH)2,故B不选;
C.NaOH、Na2CO3、Ba(OH)2分别与硫酸反应的现象为:无现象、无色气体、白色沉淀,现象不同,可鉴别,故C选;
D.NaHCO3不能鉴别NaOH、Na2CO3,故D不选;
故选C.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、发生的反应与现象为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
7.用可溶性钡盐检验SO42-的存在时,先向待测液中加入盐酸,再加可溶性钡盐.先加盐酸的作用是( )
| A. | 形成的沉淀纯度更高 | |
| B. | 形成较多的白色沉淀 | |
| C. | 排除CO32-、SO32- 和Ag+等离子的干扰 | |
| D. | 盐酸加与不加对实验结果不影响 |
8.升高温度,下列数据不一定增大的是( )
| A. | 化学反应中反应物的转化率 | B. | 化学平衡常数K | ||
| C. | 盐类的水解常数Kb | D. | 水的离子积常数Kw |
5.下列根据实验操作和现象所得出的结论正确的是( )
| 选项 | 实验操作及现象 | 结论 |
| A | 测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH,前者pH比后者的大 | 非金属性:S>C |
| B | 向苯酚浊液中滴加Na2CO3溶液,浊液变澄清 | CO32-结合质子能力比C6H5O-弱 |
| C | 向10mL 0.2mol•L-1NaOH溶液中滴入2滴0.1mol•L-1MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol•L-1FeCl3溶液,白色沉淀转化为红褐色沉淀 | 相同温度下的Ksp:Mg(OH)2>Fe(OH)3 |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置,下层溶液显紫红色 | Fe3+的氧化性大于I2 |
| A. | A | B. | B | C. | C | D. | D |
2.下列解释实验事实的化学方程式正确的是( )
| A. | FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| B. | 90℃时,测得纯水中c(H+)•c(OH-)=3.8×10-13:H2O(l?)H+(aq)+OH-(aq)△H<0 | |
| C. | 氨水中滴入酚酞溶液.溶液变红:NH3•H2O═NH4++OH- | |
| D. | 向澄清石灰水中通入过量CO2,溶液变浑浊:Ca2++CO2+2OH-═CaCO3↓+H2O |
9.下列除去杂质的方法正确的是( )
| A. | 除去CO2中混有的CO:通入O2点燃 | |
| B. | 除去铜器表面的铜绿[Cu2(OH)2CO3]:用盐酸浸泡,再用清水冲洗 | |
| C. | 除去SO2中混有的HCl,可将气体通入足量的饱和NaHSO3溶液 | |
| D. | 除去粗盐中的MgCl2、CaCl2和Na2SO4,可加入药品顺序:NaOH→Na2CO3→BaCl2→盐酸. |
6.分子式满足C8H10的苯的同系物,一氯代物共有( )
| A. | 6 种 | B. | 9 种 | C. | 10 种 | D. | 14 种 |
7.下列变化中,不需要破坏化学键的是( )
| A. | 氯化氢溶于水 | B. | 碳酸氢钠受热分解 | ||
| C. | 氯化钠熔化 | D. | 碘升华 |
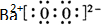 (写电子式).
(写电子式).