题目内容
12.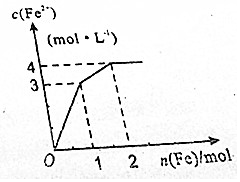 在Fe2(SO4)3和CuSO4的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示.若不考虑溶液体积变化,下列说法错误的是( )
在Fe2(SO4)3和CuSO4的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示.若不考虑溶液体积变化,下列说法错误的是( )| A. | 溶液体积为2L | B. | n(SO42-)=4mol | ||
| C. | c【Fe2(SO4)3】:c【CuSO4】=1:1 | D. | 氧化性:Fe3+>Cu2+>Fe2+ |
分析 Fe2(SO4)3和CuSO4的混合液中逐渐加入铁粉,因氧化性:Fe3+>Cu2+,结合图象可知,开始发生Fe+Fe2(SO4)3=3FeSO4,再发生Fe+CuSO4=FeSO4+Cu,由图可知各消耗1molFe,以此来解答.
解答 解:A.开始发生Fe+Fe2(SO4)3=3FeSO4,1molFe参加反应,生成3molFe2+,c(Fe2+)=3mol/L,则溶液体积为$\frac{3mol}{3mol/L}$=1L,故A错误;
B.由图可知,最终生成为4mol/LFeSO4,溶液体积为1L,则n(SO42-)=4mol,故B正确;
C.由Fe+Fe2(SO4)3=3FeSO4、Fe+CuSO4=FeSO4+Cu及两个反应均消耗1molFe可知,c【Fe2(SO4)3】:c【CuSO4】=1:1,故C正确;
D.由氧化剂的氧化性大于氧化产物的氧化性可知,氧化性:Fe3+>Cu2+>Fe2+,故D正确;
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握氧化的先后顺序、图象与反应的对应关系为解答的关键,侧重分析与计算能力的考查,注意图中参加反应的Fe与生成亚铁离子的关系,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.下列电离方程式书写不正确的是( )
| A. | 2H2O?H3O++OH- | B. | H2S?H++HS- | C. | NaHS=Na++HS- | D. | HCO3-=H++CO32- |
3.利用如图所示装置电解1L1mol•L-1的含酚酞的饱和食盐水,下列有关说法正确的是( )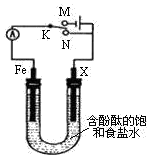

| A. | 电键K置于N处,若X为铜棒,可实现铁棒免受腐蚀 | |
| B. | 电键K置于N处,若X为锌棒,铁棒上发生的电极反应式为O2+2H2O+4e-═4OH- | |
| C. | 电键K置于M处,若X为碳棒,碳棒附近溶液变红 | |
| D. | 电键K置于M处,若X为铜棒,可实现在铁棒上镀铜 |
7.用可溶性钡盐检验SO42-的存在时,先向待测液中加入盐酸,再加可溶性钡盐.先加盐酸的作用是( )
| A. | 形成的沉淀纯度更高 | |
| B. | 形成较多的白色沉淀 | |
| C. | 排除CO32-、SO32- 和Ag+等离子的干扰 | |
| D. | 盐酸加与不加对实验结果不影响 |
17.在一定温度时,将1mol A和2mol B放入容积为5L的某密闭容器中发生如下反应:A(s)+2B(g)?C(g)+2D(g),经5min后,测得容器内B的浓度减少了0.2mol/L.下列叙述不正确的是( )
| A. | 在5min内该反应用C的浓度变化表示的反应速率为0.2mol/(L•min) | |
| B. | 5min时,容器内D的浓度为0.2mol/L | |
| C. | 当容器内压强保持恒定时,该可逆反应达到平衡状态 | |
| D. | 5min时容器内气体总的物质的量为3mol |
4.化学与生活、生产、社会密切相关,下列说法中正确的是( )
| A. | SO2有毒,可以用作某些食品防腐剂 | |
| B. | 铅笔芯的原材料为铅,儿童使用时如果用嘴吮吸能够引起铅中毒 | |
| C. | 双氧水是绿色氧化剂,可作医疗消毒剂,说明H2O2对人体无害 | |
| D. | 科学家推测月尘[即月球上直径小于10μm(1μm=1×10-6m)的浮尘]是“玉兔号”出现控制异常情况的主要原因,月尘分散在空气中形成的分散系属于胶体 |
1.下列微粒中,最外层电子数最多的是( )
| A. | Ne | B. | Al3+ | C. | Fe | D. | Fe2+ |
2.下列解释实验事实的化学方程式正确的是( )
| A. | FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| B. | 90℃时,测得纯水中c(H+)•c(OH-)=3.8×10-13:H2O(l?)H+(aq)+OH-(aq)△H<0 | |
| C. | 氨水中滴入酚酞溶液.溶液变红:NH3•H2O═NH4++OH- | |
| D. | 向澄清石灰水中通入过量CO2,溶液变浑浊:Ca2++CO2+2OH-═CaCO3↓+H2O |
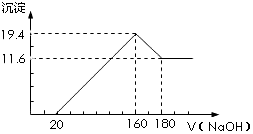 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol•L-1的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol•L-1的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求: