题目内容
1.某无色透明溶液,可能含有下列离子:Mg2+、Al3+、Fe3+、Ba2+、H+、NH4+、SO42-、HCO3-、Cl-、CO32-.取该溶液进行如下实验:①取溶液少许,滴入AgNO3溶液产生白色沉淀;
②另取溶液少许,滴入BaCl2溶液产生白色沉淀,加入足量稀硝酸沉淀不溶解;
③另取原溶液500mL,加入过氧化钠固体,产生的沉淀的物质的量与加入过氧化钠的物质的量的关系如图所示.

根据实验现象和数据分析,回答下列问题:
(1)de段发生的反应的离子方程式是4Al(OH)3+2Na2O2=4AlO2-+4Na++6H2O+O2↑或拆开写成2Na2O2+2H2O=4Na++4OH-+O2↑,Al(OH)3+OH-=AlO2-+2H2O;
(2)溶液中肯定存在的离子是H+,Mg2+,Al3+,NH4+,SO42-(用离子符号表示);
(3)溶液中可能存在的离子是Cl-(用离子符号表示);
(4)原溶液中金属阳离子的浓度分别为c(Mg2+)=0.8mol•L-1,c(Al3+)=0.4mol•L-1;
(5)请在答题卡对应图上画出加入过氧化钠从0~1.1mol时,产生气体的物质的量随加入过氧化钠物质的量变化的曲线(假设生成的气体全部逸出).
分析 无色溶液中一定不存在有色离子Fe3+,
①取溶液少许,滴入AgNO3溶液产生白色沉淀,原溶液中可能含有SO42-、HCO3-、Cl-;
②取溶液少许,滴入BaCl2溶液产生白色沉淀,加入足量稀硝酸沉淀不溶解,说明原溶液中一定存在SO42-,根据离子共存,一定不存在Ba2+;
③根据图象可知,加入过氧化钠固体,立刻生成气体,开始时没有沉淀,说明一定含有H+,之后沉淀逐渐增加,当加入0.8-0.9mol过氧化钠时没有沉淀生成,说明此时参加反应的离子为NH4+,之后沉淀部分溶解,溶解的沉淀为氢氧化铝,证明原溶液中一定存在Mg2+、Al3+;根据离子共存可知,一定不存在HCO3-,以此解答该题.
解答 解:无色溶液中一定不存在有色离子Fe3+,
①取溶液少许,滴入AgNO3溶液产生白色沉淀,原溶液中可能含有SO42-、HCO3-、Cl-;
②取溶液少许,滴入BaCl2溶液产生白色沉淀,加入足量稀硝酸沉淀不溶解,说明原溶液中一定存在SO42-,根据离子共存,一定不存在Ba2+;
③根据图象可知,加入过氧化钠固体,立刻生成气体,开始时没有沉淀,说明一定含有H+,之后沉淀逐渐增加,当加入0.8-0.9mol过氧化钠时没有沉淀生成,说明此时参加反应的离子为NH4+,之后沉淀部分溶解,溶解的沉淀为氢氧化铝,证明原溶液中一定存在Mg2+、Al3+;根据离子共存可知,一定不存在HCO3-,
(1)de段沉淀的质量减少,为氢氧化铝与氢氧化钠的反应,因加入的为过氧化钠,则反应的方程式为4Al(OH)3+2Na2O2=4AlO2-+4Na++6H2O+O2↑或拆开写成2Na2O2+2H2O=4Na++4OH-+O2↑,Al(OH)3+OH-=AlO2-+2H2O,
故答案为:4Al(OH)3+2Na2O2=4AlO2-+4Na++6H2O+O2↑或拆开写成2Na2O2+2H2O=4Na++4OH-+O2↑,Al(OH)3+OH-=AlO2-+2H2O;
(2)由以上分析可知溶液中肯定存在的离子是H+,Mg2+,Al3+,NH4+,SO42-,故答案为:H+,Mg2+,Al3+,NH4+,SO42-;
(3)溶液中可能存在的离子是Cl-,故答案为:Cl-;
(4)由图象可知n(Mg(OH)2)=0.4mol,n(Al(OH)3)=0.2mol,
则c(Mg2+)=$\frac{0.4mol}{0.5L}$=0.8mol•L-1;c(Al3+)=$\frac{0.2mol}{0.5L}$=0.4mol•L-1,
故答案为:c(Mg2+)=0.8mol•L-1,c(Al3+)=0.4mol•L-1;
(5)过氧化钠与水反应生成氧气和氢氧化钠,发生2Na2O2+2H2O=4Na++4OH-+O2↑,由图象可知,0~0.8mol、0.9~1.1mol只有氧气,而0.8~0.9mol之间既有氧气又有氨气,且0.1mol过氧化钠生成0.2mol氢氧化钠,则生成0.2mol氨气,图象为 ,
,
故答案为: .
.
点评 本题考查以常见离子的检验为载体考查无机物的推断,侧重于学生的分析、计算能力的考查,题目难度中等,注意掌握常见离子的性质及检验方法,正确分析图象曲线变化是解答本题关键,试题培养了学生的分析、理解能力.

 科学实验活动册系列答案
科学实验活动册系列答案| A. | 玻璃钢和钢化玻璃成分不同,但都属于复合材料 | |
| B. | Fe(OH)3胶体无色、透明,能发生丁达尔现象 | |
| C. | H2、SO2、Cl2都可用浓硫酸干燥 | |
| D. | SiO2既能和NaOH溶液反应又能和氢氟酸反应,所以是两性氧化物 |
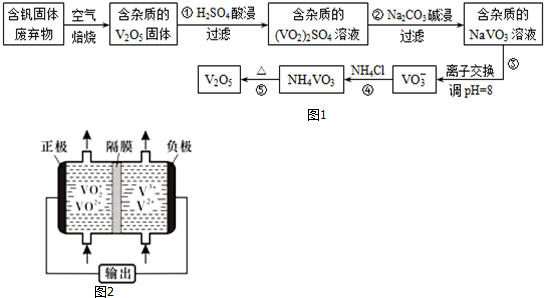
部分含钒化合物在水中的溶解性如下表:
| 物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
| 溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
(1)反应①所得溶液中除H+之外的阳离子有VO2+和Al3+.
(2)反应②碱浸后滤出的固体主要成分是Al(OH)3(写化学式).
(3)反应④的离子方程式为VO3-+NH4+=NH4VO3↓.
(4)25℃、101 kPa时,4Al(s)+3O2(g)═2Al2O3(s)△H1=-a kJ/mol
4V(s)+5O2(g)═2V2O5(s)△H2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s)△H=-$\frac{5a-3b}{2}$kJ/mol.
(5)钒液流电池(如图2所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过.电池放电时负极的电极反应式为V2+-e-=V3+,电池充电时阳极的电极反应式是VO2+-e-+H2O=VO2++2H+.
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2VO2++H2C2O4+2H+═2VO2++2CO2↑+2H2O.取25.00mL 0.1000 mol/L
H2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0mL,由此可知,该(VO2)2SO4溶液中钒的含量为10.6g/L.
| A. | 所需仪器有:100mL容量瓶、烧杯、玻璃棒、胶头滴管、托盘天平 | |
| B. | 将量取的浓盐酸先倒入容量瓶,再加入蒸馏水至刻度线,摇匀 | |
| C. | 将溶液转移入容量瓶,要用玻璃棒引流 | |
| D. | 定容时仰视刻度,所配溶液浓度偏小 |

| A. | 图a中,随着电解的进行,溶液中c(H+)增大 | |
| B. | 图b中,Mg电极做电池负极 | |
| C. | 图c中,发生的反应为Co+Cd2+=Cd+Co2+ | |
| D. | 图d中,K分别与M、N连接,Fe电极均受到保护 |
| A. | 某气体$\stackrel{通入品红溶液中}{→}$品红溶液褪色 结论:某气体一定是SO2 | |
| B. | 某气体$\stackrel{通入澄清石灰水}{→}$ 产生白色沉淀 结论:某气体一定是CO2 | |
| C. | 某溶液$\stackrel{打开瓶盖}{→}$冒白雾$\stackrel{将沾有浓氨水的玻璃棒靠近}{→}$ 白烟 结论:原溶液一定是浓盐酸 | |
| D. | 某溶液$\stackrel{滴加KSCN溶液液}{→}$ 血红色溶液 结论:原溶液中一定含有Fe3+ |
①将X加入足量水中,得到不溶物Y和溶液Z;
②取少量Y加入足量浓盐酸,加热,产生黄绿色气体,并有少量红色不溶物;
③取②中溶液少量,加入KSCN溶液,溶液呈红色;
④将Z溶液中滴在蓝色石蕊试纸上,试纸变红,取少量试液,硝酸酸化的氯化钡溶液,有白色沉淀生成;在上层清液中滴加硝酸银溶液,有白色沉淀.
分析以上实验现象,下列结论正确的是( )
| A. | X中一定不存在FeO | |
| B. | Y中一定含有MnO2,Fe2O3 | |
| C. | Z溶液中一定含有Na2SO4,不能确定是否含有AlCl3 | |
| D. | 不溶物Y中一定含有Fe和CuO |
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+Fe3+═Cu2++Fe2+ | |
| B. | Na2O2与H2O反应产生O2:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| C. | 将铁溶于稀盐酸:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 向氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |