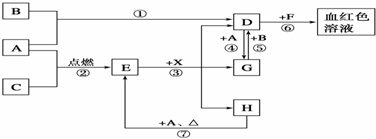
题目内容
13.固体粉末X中可能含有Fe、Fe2O3、FeO、CuO、MnO2、AlCl3、Na2SO4中的若干种.为确定该固体粉末的成分,某同学依次进行了以下实验:①将X加入足量水中,得到不溶物Y和溶液Z;
②取少量Y加入足量浓盐酸,加热,产生黄绿色气体,并有少量红色不溶物;
③取②中溶液少量,加入KSCN溶液,溶液呈红色;
④将Z溶液中滴在蓝色石蕊试纸上,试纸变红,取少量试液,硝酸酸化的氯化钡溶液,有白色沉淀生成;在上层清液中滴加硝酸银溶液,有白色沉淀.
分析以上实验现象,下列结论正确的是( )
| A. | X中一定不存在FeO | |
| B. | Y中一定含有MnO2,Fe2O3 | |
| C. | Z溶液中一定含有Na2SO4,不能确定是否含有AlCl3 | |
| D. | 不溶物Y中一定含有Fe和CuO |
分析 ①将X加入足量水中,得到不溶物Y和溶液Z,Y可能为Fe、FeO、CuO、MnO2中的物质,Z可能为AlCl3、Na2SO4中的物质;
②取少量Y加入足量浓盐酸,加热,产生黄绿色气体,并有少量红色不溶物,黄绿色气体为氯气,说明Y中含有MnO2,红色不溶物为铜,说明反应后有Cu生成,说明Y中含有的CuO与酸反应生成的CuCl2被置换出来了,可说明Y中还含有Fe,所以Y中含有Fe、CuO、MnO2,不能确定是否含有FeO;
③取②中溶液少量,加入KSCN溶液,溶液呈红色,说明含有铁离子,可由氯气氧化生成,不能说明含有Fe2O3;
④将Z溶液中滴在蓝色石蕊试纸上,试纸变红,说明水解呈酸性,应含有AlCl3,取少量试液,硝酸酸化的氯化钡溶液,有白色沉淀生成,为硫酸钡沉淀,说明含有Na2SO4,在上层清液中滴加硝酸银溶液,有白色沉淀,为氯化银沉淀,以此解答该题.
解答 解:①将X加入足量水中,得到不溶物Y和溶液Z,Y可能为Fe、FeO、CuO、MnO2中的物质,Z可能为AlCl3、Na2SO4中的物质;
②取少量Y加入足量浓盐酸,加热,产生黄绿色气体,并有少量红色不溶物,黄绿色气体为氯气,说明Y中含有MnO2,红色不溶物为铜,说明反应后有Cu生成,说明Y中含有的CuO与酸反应生成的CuCl2被置换出来了,可说明Y中还含有Fe,所以Y中含有Fe、CuO、MnO2,不能确定是否含有FeO;
③取②中溶液少量,加入KSCN溶液,溶液呈红色,说明含有铁离子,可由氯气氧化生成,不能说明含有Fe2O3;
④将Z溶液中滴在蓝色石蕊试纸上,试纸变红,说明水解呈酸性,应含有AlCl3,取少量试液,硝酸酸化的氯化钡溶液,有白色沉淀生成,为硫酸钡沉淀,说明含有Na2SO4,在上层清液中滴加硝酸银溶液,有白色沉淀,为氯化银沉淀,
A.由以上分析可知,不能确定是否含有FeO,故A错误;
B.由以上分析可知不能确定是否含有Fe2O3,故B错误;
C.Z溶液中滴在蓝色石蕊试纸上,试纸变红,说明水解呈酸性,应含有AlCl3,故C错误;
D.由实验②可知一定含有Fe和CuO,故D正确.
故选D.
点评 本题考查无机物的推断,侧重于物质的检验和鉴别的实验方案的设计以及元素化合物知识的综合应用,注意把握物质的性质,根据反应的现象进行判断.

| A. | 4种、3种 | B. | 3种、4种 | C. | 6种、2种 | D. | 2种、6种 |
| A. | 1s22s22p5 | B. | 1s22s22p2 | C. | 1s22s22p63s1 | D. | 1s22s22p63s2 |
| A. | 将二氧化硫通入品红溶液,溶液显红色,加热后变为无色 | |
| B. | 向溶液中加入新制氯水,再滴加KSCN溶液,若溶液变红,则证明原溶液中一定含有Fe2+ | |
| C. | 将湿润的红纸条放进盛有氯气的集气瓶中,红纸条褪色 | |
| D. | 向酸性高锰酸钾溶液中滴加Na2SO3溶液,溶液无明显变化 |
①Al ②AlCl3 ③Al2O3 ④Al(OH)3 ⑤NaHCO3.
| A. | 全部 | B. | ①③④⑤ | C. | ②③④⑤ | D. | ①②④ |
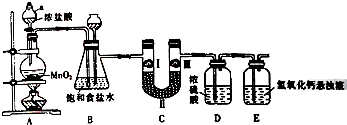 氯气在工农业生产在应用非常广泛.如图是实验室制备氯气并进行一系列相关实验的装置.
氯气在工农业生产在应用非常广泛.如图是实验室制备氯气并进行一系列相关实验的装置.已知:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(1)仪器a的名称为分液漏斗.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl气体;装置B也作安全瓶,用来监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:锥形瓶中液面下降,长颈漏斗中液面上升.
(3)装置C的作用是验证氯气是否具有漂白性,为此装置C中Ⅰ、Ⅱ、Ⅲ处依次放入c(填字母).
| 选项 | a | b | c |
| Ⅰ | 湿润的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |