题目内容
14.某学生欲测定未知物质的量浓度的氢氧化钠溶液:准确称取3.90g烧碱样品,将样品配成250mL待测液,用0.2000mol•L-1标准盐酸滴定待测烧碱溶液选择酚酞作指示剂.请填写下列空白:(1)用标准的盐酸滴定待测的氢氧化钠溶液时,左手控制酸式滴定管活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化.直到因加入一滴盐酸,溶液的颜色由红色变为无色,且在半分钟内不变色,即停止滴定.
(2)根据下列数据,计算待测烧碱溶液的浓度:0.4000mol•L-1.
| 滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 0.70 | 23.70 |
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
E.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出.
分析 (1)酸碱中和滴定时,左手把握滴定管的活塞,右手摇动锥形瓶,眼睛要注视锥形瓶内溶液的颜色变化;如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(2)先根据数据的有效性,舍去第三次数据,然后求出其他两次平均消耗V(盐酸),接着根据HCl+NaOH═NaCl+H2O求出C(NaOH);
(3)根据c(待测)=$\frac{c(标准)×c(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:(1)酸碱中和滴定时,右手摇动锥形瓶,眼睛要注视锥形瓶内溶液的颜色变化;滴定终点时溶液颜色由红色变为无色,且半分钟内不变色;
故答案为:摇动锥形瓶;锥形瓶中溶液颜色的变化;红色变为无色;
(2)三次消耗的盐酸的体积分别为:19.90mL、20.10mL、23.00mL,第三次数据相差加大,舍去,其他两次平均消耗V(盐酸)=20.00mL,
HCl+NaOH=NaCl+H2O
1 1
20.00mL×0.2000mol•L-1 10.00mL×C(NaOH)
则C(NaOH)=0.4000mol•L-1;
故答案为:0.4000mol•L-1;
(3)A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×c(标准)}{V(待测)}$分析,测定c(待测)偏大,故A错误;
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=$\frac{c(标准)×c(标准)}{V(待测)}$分析,测定c(待测)无影响,故B错误;
C.酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×c(标准)}{V(待测)}$分析,测定c(待测)偏大,故C错误;
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×c(标准)}{V(待测)}$分析,测定c(待测)偏低,故D正确;
E.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出,待测液的物质的量偏小,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×c(标准)}{V(待测)}$分析,测定c(待测)偏低,故E正确;
故答案为:DE.
点评 本题考查了中和滴定操作及误差分析,操作时要规范,分析误差时要看是否影响标准体积的用量即可,本题难度中等.

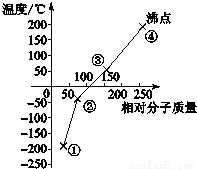
| A. | 单质①是最活泼的非金属单质 | |
| B. | 单质②能使品红溶液褪色 | |
| C. | 保存少量的单质③时加少量水进行水封 | |
| D. | 单质④的氢化物在卤素氢化物中沸点最高 |
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | c(H2SO4)/mol•L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
(2)甲同学设计如图实验流程探究Na2S2O3的化学性质.
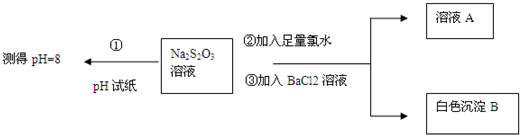
(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和还原 性.
(Ⅱ)生成白色沉淀B的离子方程式是SO42-+Ba2+=BaSO4↓.
(Ⅲ)已知Na2S2O3溶液与Cl2反应时,1mol Na2S2O3转移8mol电子.该反应的离子方程式是S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+.
| A. | 未用标准液润洗滴定管 | |
| B. | 盛标准液的滴定管尖嘴部分有气泡未排除就开始滴定 | |
| C. | 往锥形瓶中加待测液时,锥形瓶中有少许水 | |
| D. | 振荡时锥形瓶中液滴飞溅出来 |
 中和滴定是化学定量实验之一.某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:
中和滴定是化学定量实验之一.某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:(1)在中和滴定的过程中有如下操作:①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤,则在操作过程中正确的顺序是③⑤①②④.(写序号)
(2)选用的指示剂是b.(a、石蕊 b、甲基橙)
(3)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化.
(4)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是D.
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
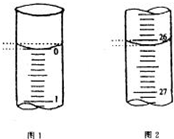
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数据填入下面表格的空白处.
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L 盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | |||
| 第二次 | 25.00 | 2.00 | 28.08 | 26.08 |
| 第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(7)滴定终点的判定依据是溶液颜色由黄色突变为橙色,且半分钟内不褪色.
| A. | 氧化铁 | B. | 铝热剂 | C. | 玻璃 | D. | 钢 |
| A. | Cl2、Br2、I2的熔沸点依次升高 | |
| B. | 因为自然界中没有游离态的P元素,所以非金属性P>N | |
| C. | 灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,一定无K+ | |
| D. | 已知FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变程度相同 |
| A. | As的原子半径大于P,AsH3比PH3的热稳定性强 | |
| B. | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 | |
| C. | Al2O3和MgO均可与NaOH溶液反应 | |
| D. | SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4 |