题目内容
19. 中和滴定是化学定量实验之一.某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:
中和滴定是化学定量实验之一.某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:(1)在中和滴定的过程中有如下操作:①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤,则在操作过程中正确的顺序是③⑤①②④.(写序号)
(2)选用的指示剂是b.(a、石蕊 b、甲基橙)
(3)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化.
(4)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是D.
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
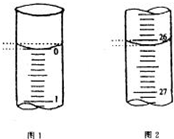
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数据填入下面表格的空白处.
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L 盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | |||
| 第二次 | 25.00 | 2.00 | 28.08 | 26.08 |
| 第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(7)滴定终点的判定依据是溶液颜色由黄色突变为橙色,且半分钟内不褪色.
分析 (1)滴定操作中,首先需要检漏,然后洗涤仪器、润洗滴定管,再向滴定管中装入溶液,最后进行滴定,据此对各操作进行排序;
(2)根据盐酸和氢氧化钠恰好反应溶液呈中性,可选择碱性变色范围内的指示剂酚酞或酸性碱性变色范围内的指示剂甲基橙;
(3)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化,以判定滴定终点;
(4)根据c(待测)=$\frac{c(标准)×c(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(5)根据滴定管的结构和精确度以及测量的原理;
(6)先根据数据的有效性求出平均消耗V(盐酸),接着根据反应:HCl+NaOH=NaCl+H2O求出c(NaOH);
(7)滴定终点时溶液颜色由黄色突变为橙色,且半分钟内不褪色;
解答 解:(1)中和滴定的操作步骤为:③检查滴定管是否漏水 ⑤洗涤 ①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ④滴定,所以正确的滴定顺序为:③⑤①②④;
故答案为:③⑤①②④;
(2)盐酸和氢氧化钠恰好反应溶液呈中性,可选择酚酞或甲基橙作指示剂;
故选:b;
(3)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化;
故答案为:锥形瓶中溶液颜色的变化;
(4)A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液,溶液被稀释,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×c(标准)}{V(待测)}$分析,测定c(待测)偏大,故A错误;
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=$\frac{c(标准)×c(标准)}{V(待测)}$分析,测定c(待测)无影响,故B错误;
C.酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×c(标准)}{V(待测)}$分析,测定c(待测)偏大,故C错误;
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×c(标准)}{V(待测)}$分析,测定c(待测)偏低,故D正确;
故选D;
(5)起始读数为0.00mL,终点读数为26.10mL,盐酸溶液的体积为26.10mL,
故答案为:0.00;26.10;26.10;
(6)三次滴定消耗盐酸的体积分别为26.10mL,26.08mL,26.12mL,三组数据均有效,平均消耗V(盐酸)=26.10mL,
HCl+NaOH=NaCl+H2O
1 1
0.02610L×0.1000mol/L 0.025L×C(NaOH)
则c(NaOH)=$\frac{0.02610L×0.1000mol/L}{0.025L}$=0.1044mol/L;
故答案为:0.1044mol/L;
(7)滴定终点的判定依据是溶液颜色由黄色突变为橙色,且半分钟内不褪色;
故答案为:溶液颜色由黄色突变为橙色,且半分钟内不褪色.
点评 本题主要考查了中和滴定操作、误差分析以及烧碱的浓度的计算,难度中等,注意知识的积累,侧重于考查学生的实验能力和计算能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | CO | B. | CH4 | C. | CH3CH3 | D. | CH2=CH2 |
| A. | 使甲基橙变红色的溶液中:Na+、Fe2+、MnO4-、AlO2- | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | pH=0的溶液中:Al3+、Ag(NH3)2+、Cl-、SO42- | |
| D. | 加入Mg能放出H2的溶液中:Ca2+、NH4+、ClO-、NO3- |
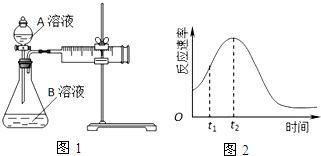
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol•L-1H2C2O4溶液 | 30mL 0.01mol•L-1KMnO4溶液 |
| ② | 20mL 0.2mol•L-1H2C2O4溶液 | 30mL 0.01mol•L-1KMnO4溶液 |
(2)该实验探究的是浓度因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是①<②(填实验序号).
(3)若实验①在2min末收集了2.24mL CO2(标准状况下),则在2min末,c(MnO4-)=0.0056mol•L-1.(假设混合溶液体积为50mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率.(一条即可)
(5)小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:
①该反应放热;
②产物Mn2+是反应的催化剂.
(1)用标准的盐酸滴定待测的氢氧化钠溶液时,左手控制酸式滴定管活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化.直到因加入一滴盐酸,溶液的颜色由红色变为无色,且在半分钟内不变色,即停止滴定.
(2)根据下列数据,计算待测烧碱溶液的浓度:0.4000mol•L-1.
| 滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 0.70 | 23.70 |
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
E.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出.
现用4mL 0.001mol/L KMnO4溶液与2mL 0.01mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | |
| Ⅳ | 1mL | 20 | 1mL蒸馏水 |
(2)对比实验I和II(用Ⅰ~Ⅳ表示,下同),可以研究催化剂对化学反应速率的影响;如果研究温度对化学反应速率的影响,对比实验I和III.
(3)对比实验Ⅰ和Ⅳ,可以研究硫酸的浓度(或氢离子的浓度)对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是确保对比实验中c(KMnO4)、c(H2C2O4)相同(溶液总体积相同).
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 过量浓溴水 | 过滤 |
| B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 溴苯(溴) | 氢氧化钠溶液 | 分液 |
| D | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |




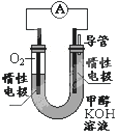 甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.
甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.