题目内容
取金属Na、Mg、Al各0.1mol,分别投入均盛有100mL 0.5mol/L盐酸的烧杯中,充分反应后放出H2的体积( )
| A、一样多 | B、Na最多 |
| C、Mg最多 | D、Al最多 |
考点:常见金属元素的单质及其化合物的综合应用,化学方程式的有关计算
专题:几种重要的金属及其化合物
分析:钠可与水反应,盐酸不足,Mg、Al生成氢气相当,但小于钠与水反应生成的氢气,以此解答.
解答:
解:Na、Mg、Al各0.1mol,n(HCl)=0.1L×0.5mol/L=0.05mol,2Na~2HCl~H2,2Mg~4HCl~2H2,2Al~6HCl~3H2,盐酸完全反应,Mg、Al生成氢气为0.025mol,钠和水反应,0.1mol钠可生成0.05mol氢气,
则钠生成氢气最多.
故选B.
则钠生成氢气最多.
故选B.
点评:本题考查钠的性质,注意钠和水反应的特点,根据物质的量的大小可与酸、水反应的特点比较生成氢气的多少,难度不大.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
用NA表示阿伏加德罗常数的值下列叙述正确的是( )
| A、0.1mol Na生成Na202时,失去的电子数为O.2NA |
| B、NA个N2与NA个H2的质量比等于14:1 |
| C、常温常压下,11.2L CO2中所占的分子数为0.5NA |
| D、4g NaOH溶解于500mL水中.所得溶液的物质的量浓度为0.2mol/L |
高铁电池是一种新型可充电电池,电解质溶液为KOH,放电时的总反应式为:3Zn+2K2FeO4+8H2O?3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是( )
| A、充电时阳极反应式为:3Zn(OH)2+6e-═3Zn+6OH- |
| B、放电时OH-向正极移动 |
| C、充电时每转移3mol电子,阳极有1mol Fe(OH)3被还原 |
| D、放电时负极反应为:3Zn-6e-+6OH-═3Zn(OH)2 |
用下列实验装置进行相应实验,能达到实验目的是( )
A、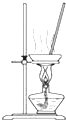 如图所示装置,蒸干AlCl3饱和溶液制备AlCl3晶体 |
B、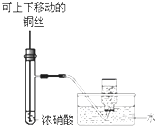 如图所示装置,制备并收集少量NO2气体 |
C、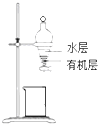 如图所示装置,分离CCl4萃取I2水后的有机层和水层 |
D、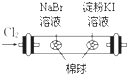 如图所示装置,可以证明氧化性:Cl2>Br2>I2 |
下列各组指定原子序数的元素,能形成A2B3型化合物的是( )
| A、6和8 | B、11和9 |
| C、12和17 | D、13和8 |
 I.有9种微粒:①NH2-;②-NH2;③Br-;④OH-;⑤-NO2;⑥-OH;⑦NO2;⑧CH3+;⑨-CH3
I.有9种微粒:①NH2-;②-NH2;③Br-;④OH-;⑤-NO2;⑥-OH;⑦NO2;⑧CH3+;⑨-CH3

