题目内容
高纯硝酸锶[化学式:Sr(NO3)2]用于制造信号灯、光学玻璃等.
(1)工业级硝酸锶中常含有硝酸钙、硝酸钡等杂质,其中硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸.请结合相关信息,补充完整提纯硝酸锶的下列实验步骤:
①取含杂质的硝酸锶样品, ,搅拌.
② .
③将滤渣溶于水中,加略过量铬酸使Ba2+沉淀,静置后加入肼(N2H4)将过量铬酸还原,调节pH=7~8,过滤.
④将滤液用硝酸调节pH=2~3, ,过滤,洗涤.
⑤将得到的Sr(NO3)2?2H2O晶体在100℃条件下干燥,得到高纯硝酸锶.
(2)Sr(NO3)2受热易分解,生成Sr(NO2)2和O2;在500℃时Sr(NO2)2进一步分解生成SrO及氮氧化物.取一定质量含Sr(NO2)2的Sr(NO3)2样品,加热至完全分解,得到5.20g SrO固体和5.08g混合气体.计算该样品中Sr(NO3)2的质量分数(写出计算过程).
(1)工业级硝酸锶中常含有硝酸钙、硝酸钡等杂质,其中硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸.请结合相关信息,补充完整提纯硝酸锶的下列实验步骤:
①取含杂质的硝酸锶样品,
②
③将滤渣溶于水中,加略过量铬酸使Ba2+沉淀,静置后加入肼(N2H4)将过量铬酸还原,调节pH=7~8,过滤.
④将滤液用硝酸调节pH=2~3,
⑤将得到的Sr(NO3)2?2H2O晶体在100℃条件下干燥,得到高纯硝酸锶.
(2)Sr(NO3)2受热易分解,生成Sr(NO2)2和O2;在500℃时Sr(NO2)2进一步分解生成SrO及氮氧化物.取一定质量含Sr(NO2)2的Sr(NO3)2样品,加热至完全分解,得到5.20g SrO固体和5.08g混合气体.计算该样品中Sr(NO3)2的质量分数(写出计算过程).
考点:物质分离和提纯的方法和基本操作综合应用,化学方程式的有关计算,难溶电解质的溶解平衡及沉淀转化的本质
专题:实验题,电离平衡与溶液的pH专题
分析:(1)硝酸锶中含有硝酸钙、硝酸钡等杂质,因硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸,则可先加入浓硝酸,溶解硝酸钙,过滤后再加入过量铬酸使Ba2+沉淀,过滤后蒸发、浓缩溶液可得硝酸锶;
(2)根据物质的质量结合质量守恒定律列式计算.
(2)根据物质的质量结合质量守恒定律列式计算.
解答:
解:(1)硝酸锶中含有硝酸钙、硝酸钡等杂质,因硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸,则可先加入浓硝酸,溶解硝酸钙,过滤后再加入过量铬酸使Ba2+沉淀,过滤后蒸发、浓缩溶液可得硝酸锶,则
①应先加入浓硝酸,以除去硝酸钙,故答案为:向其中加入浓HNO3;
②将固体和液体分离,用过滤的方法可除去硝酸钙,并用浓硝酸洗涤沉淀,答案为:过滤,并用浓HNO3洗涤滤渣;
④将硝酸锶溶液蒸发浓缩、冷却结晶可得到硝酸锶晶体,答案为:蒸发浓缩,冷却结晶;
(2)m(样品)=5.20 g+5.08 g=10.28 g,
n(SrO)=
=0.05 mol,
n[Sr(NO3)2]×212 g?mol-1+n[Sr(NO2)2]×180 g?mol-1=10.28 g,
n[Sr(NO3)2]+n[Sr(NO2)2]=0.05 mol,
解得:n[Sr(NO3)2]=0.04 mol,
n[Sr(NO2)2]=0.01 mol,
ω[Sr(NO3)2]=
×100%=82.49%,
答:样品中Sr(NO3)2的质量分数为82.49%.
①应先加入浓硝酸,以除去硝酸钙,故答案为:向其中加入浓HNO3;
②将固体和液体分离,用过滤的方法可除去硝酸钙,并用浓硝酸洗涤沉淀,答案为:过滤,并用浓HNO3洗涤滤渣;
④将硝酸锶溶液蒸发浓缩、冷却结晶可得到硝酸锶晶体,答案为:蒸发浓缩,冷却结晶;
(2)m(样品)=5.20 g+5.08 g=10.28 g,
n(SrO)=
| 5.20g |
| 104g/mol |
n[Sr(NO3)2]×212 g?mol-1+n[Sr(NO2)2]×180 g?mol-1=10.28 g,
n[Sr(NO3)2]+n[Sr(NO2)2]=0.05 mol,
解得:n[Sr(NO3)2]=0.04 mol,
n[Sr(NO2)2]=0.01 mol,
ω[Sr(NO3)2]=
| 0.04mol×212g/mol |
| 10.28g |
答:样品中Sr(NO3)2的质量分数为82.49%.
点评:本题考查物质的分离、提纯的综合操作,涉及学生的分析能力、实验能力和计算能力的考查,为高频考点,注意把握实验的原理和操作,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
目前,城市污水处理厂多采用活性污泥法二级处理工艺来进行污水处理.该工艺的一级处理是在沉淀池中通过过滤除去污水中固体沉淀物和悬浮物,再加入一定量的化学试剂中和酸性或碱性物质.二级处理是采用空气曝气活性污泥法,利用细菌等微生物除去废水中的有机污染物.在这种污水处理工艺中,采用的污水处理方法有( )
①化学法 ②生物法 ③物理法.
①化学法 ②生物法 ③物理法.
| A、①② | B、②③ | C、①③ | D、①②③ |
取金属Na、Mg、Al各0.1mol,分别投入均盛有100mL 0.5mol/L盐酸的烧杯中,充分反应后放出H2的体积( )
| A、一样多 | B、Na最多 |
| C、Mg最多 | D、Al最多 |
下列物质的分类全部正确的是( )
| A、NO2-酸性氧化物 Na2O2-碱性氧化物 Al2O3-两性氧化物 |
| B、汽油-混合物 胆矾-纯净物 金刚石-单质 |
| C、纯碱-碱 硫化氢-酸 小苏打-酸式盐 |
| D、液氯-非电解质 硫酸钡-强电解质 醋酸-弱电解质 |



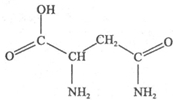 天冬酰胺(结构如图)在芦笋中含量丰富,具有提高身体免疫力的功效.
天冬酰胺(结构如图)在芦笋中含量丰富,具有提高身体免疫力的功效.