题目内容
 一定条件下,在体积为10L的固定容器中发生反应:
一定条件下,在体积为10L的固定容器中发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应过程如图:
下列说法正确的是( )
| A、t1 min时正、逆反应速率相等 | ||
| B、X曲线表示NH3的物质的量随时间变化的关系 | ||
C、0~8 min,H2的平均反应速率v(H2)=
| ||
| D、10~12 min,升高温度使反应速率加快,平衡正向移动 |
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:A、根据图象可知,t1 min时X、Y的物质的量相等,不能代表反应速率的关系,故无法判断,据此答题;
B、根据图可知,在0~8 min时,X增加了0.6mol,Y减小了0.9mol,X、Y变化了的物质的量之比为2:3,根据物质变化了的物质的量之比等于化学反应中计量数之比可知,X为氨气的物质的量随时间变化的曲线,据此答题;
C、0~8 min时,由图可知NH3的平均反应速率v(NH3)=
=
mol?L-1?min-1,根据速率之比等于化学计量数之比得,v(H2)=
×v(NH3)=
mol?L-1?min-1,据此答题;
D、因为该反应为放热反应,由图可知在10~12 min生成物变多,反应物变少,平衡正向移动,所以此时应为降低温度,据此判断.
B、根据图可知,在0~8 min时,X增加了0.6mol,Y减小了0.9mol,X、Y变化了的物质的量之比为2:3,根据物质变化了的物质的量之比等于化学反应中计量数之比可知,X为氨气的物质的量随时间变化的曲线,据此答题;
C、0~8 min时,由图可知NH3的平均反应速率v(NH3)=
| ||
| 8 min |
| 3 |
| 400 |
| 3 |
| 2 |
| 9 |
| 800 |
D、因为该反应为放热反应,由图可知在10~12 min生成物变多,反应物变少,平衡正向移动,所以此时应为降低温度,据此判断.
解答:
解:A、根据图象可知,t1 min时X、Y的物质的量相等,不能代表反应速率的关系,故无法判断,故A错误;
B、根据图可知,在0~8 min时,X增加了0.6mol,Y减小了0.9mol,X、Y变化了的物质的量之比为2:3,根据物质变化了的物质的量之比等于化学反应中计量数之比可知,X为氨气的物质的量随时间变化的曲线,故B正确;
C、0~8 min时,由图可知NH3的平均反应速率v(NH3)=
=
mol?L-1?min-1,根据速率之比等于化学计量数之比得,v(H2)=
×v(NH3)=
mol?L-1?min-1,故C错误;
D、因为该反应为放热反应,由图可知在10~12 min生成物变多,反应物变少,平衡正向移动,所以此时应为降低温度,故D错误;
故选B.
B、根据图可知,在0~8 min时,X增加了0.6mol,Y减小了0.9mol,X、Y变化了的物质的量之比为2:3,根据物质变化了的物质的量之比等于化学反应中计量数之比可知,X为氨气的物质的量随时间变化的曲线,故B正确;
C、0~8 min时,由图可知NH3的平均反应速率v(NH3)=
| ||
| 8 min |
| 3 |
| 400 |
| 3 |
| 2 |
| 9 |
| 800 |
D、因为该反应为放热反应,由图可知在10~12 min生成物变多,反应物变少,平衡正向移动,所以此时应为降低温度,故D错误;
故选B.
点评:本题要主考查了影响化学反应速率和化学平衡移动的因素,难度不大,注重对化学平衡的基本原理的理解.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
质量为ag的铜丝,在空气中灼热变黑,趁热放入下列物质中,铜丝变红,质量大于a g的是( )
| A、盐酸 |
| B、CH3COOH |
| C、C2H5OH |
| D、NaOH |
应用元素周期律推断,下列说法正确的是( )
| A、Sr(锶)的碳酸盐难溶于水 |
| B、Tl(铊)的氢氧化物是两性氢氧化物 |
| C、H2Se比H2S更稳定 |
| D、H3AsO4酸性比H3PO4强 |
在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?2Z(g)此反应达到平衡的标志是( )
| A、正反应和逆反应的速率都为零 |
| B、容器内各物质的浓度不随时间变化 |
| C、容器内X、Y、Z的浓度之比为1:2:2 |
| D、单位时间消耗0.1mol X同时生成0.2mol Z |
最近研制出一种新材料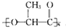 ,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )
,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )
 ,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )
,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )| A、聚乳酸是一种纯净物 |
B、聚乳酸的单体是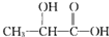 |
| C、聚乳酸是一种羧酸 |
| D、聚乳酸是由其单体通过加聚反应合成的 |