题目内容
氨是中学化学中的常见物质,也是工业上的重要原料.
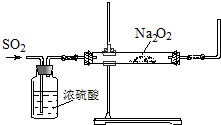
(1)某学习小组欲制备少量的氨水,供选用的试剂有:①NH4Cl ②(NH4)2CO3,提供的装置如图:

请回答下列问题:
①从提供的仪器中选择并组装一套合理、简洁的实验装置,按气流方向连接顺序为(用图中标注的导管口符号表示)a→ ;
②装置A的试管中发生反应的化学方程式为 .
(2)在一定温度和催化剂作用下,氨被催化氧化成NO,NO极易氧化成NO2,NO2被水吸收生成硝酸和NO,工业上利用该原理制备硝酸.
①写出氨发生催化氧化反应的化学方程式 .
②在制取硝酸过程中,可以循环使用的物质有(写化学式) ;若将氨气通入硝酸中,反应后产物中含有的化学键类型有 .
③写出铜与稀硝酸反应的离子方程式 .
(3)为检验某种铵态氮肥,某同学进行了如下实验:
①取少量氮肥样品加热,产生两种气体,一种能使湿润的红色石蕊试纸变蓝色,另一种能使澄清石灰水变浑浊;②取少量氮肥样品溶于水,向其中加入少量BaCl2溶液后无明显现象.
则该氮肥的主要化学成分是 ,该氮肥的溶液与足量NaOH溶液在加热条件下反应的离子方程式为 .
(1)某学习小组欲制备少量的氨水,供选用的试剂有:①NH4Cl ②(NH4)2CO3,提供的装置如图:

请回答下列问题:
①从提供的仪器中选择并组装一套合理、简洁的实验装置,按气流方向连接顺序为(用图中标注的导管口符号表示)a→
②装置A的试管中发生反应的化学方程式为
(2)在一定温度和催化剂作用下,氨被催化氧化成NO,NO极易氧化成NO2,NO2被水吸收生成硝酸和NO,工业上利用该原理制备硝酸.
①写出氨发生催化氧化反应的化学方程式
②在制取硝酸过程中,可以循环使用的物质有(写化学式)
③写出铜与稀硝酸反应的离子方程式
(3)为检验某种铵态氮肥,某同学进行了如下实验:
①取少量氮肥样品加热,产生两种气体,一种能使湿润的红色石蕊试纸变蓝色,另一种能使澄清石灰水变浑浊;②取少量氮肥样品溶于水,向其中加入少量BaCl2溶液后无明显现象.
则该氮肥的主要化学成分是
考点:氨的制取和性质,氨的化学性质,硝酸的化学性质
专题:氮族元素
分析:(1)①根据碳酸铵加热分解产生氨气、水和二氧化碳;
②根据题干可知将氨气溶于水形成氨水,生成的氨气需通过碱石灰除去二氧化碳、再通入水中即可;
(2)①氨发生催化氧化反应生成一氧化氮和水;
②在制取硝酸过程中,氨气催化氧化生成一氧化氮和水,一氧化氮和氧气 反应生成二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,可以循环使用的物质为NO;氨气通入硝酸中,反应后产物为硝酸铵,是两种化合价,结构中含有的化学键类型为离子键和共价键;
③铜与稀硝酸反应生成硝酸铜,一氧化氮和水;
(3)①加热氮肥样品生成两种气体,其中一种气体能使湿润的红色石蕊试纸变蓝,该气体为氨气,说明含有铵根离子,另一种气体能使澄清石灰水变浑浊,说明碳酸根离子或碳酸氢根离子,②取少量该氮肥样品溶于水,并加入少量BaCl2溶液,没有明显变化,说明没有碳酸氢根离子,由此推导出氮肥的主要成分.
②根据题干可知将氨气溶于水形成氨水,生成的氨气需通过碱石灰除去二氧化碳、再通入水中即可;
(2)①氨发生催化氧化反应生成一氧化氮和水;
②在制取硝酸过程中,氨气催化氧化生成一氧化氮和水,一氧化氮和氧气 反应生成二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,可以循环使用的物质为NO;氨气通入硝酸中,反应后产物为硝酸铵,是两种化合价,结构中含有的化学键类型为离子键和共价键;
③铜与稀硝酸反应生成硝酸铜,一氧化氮和水;
(3)①加热氮肥样品生成两种气体,其中一种气体能使湿润的红色石蕊试纸变蓝,该气体为氨气,说明含有铵根离子,另一种气体能使澄清石灰水变浑浊,说明碳酸根离子或碳酸氢根离子,②取少量该氮肥样品溶于水,并加入少量BaCl2溶液,没有明显变化,说明没有碳酸氢根离子,由此推导出氮肥的主要成分.
解答:
解:(1)①将氨气溶于水形成氨水,生成的氨气需通过碱石灰除去二氧化碳、再通入水中即可,故答案为:edf;
②碳酸铵加热分解产生氨气、水和二氧化碳,化学方程式为:(NH4)2CO3
2NH3↑+CO2↑+H2O,故答案为:(NH4)2CO3
2NH3↑+CO2↑+H2O;
(2)①氨发生催化氧化反应生成一氧化氮和水,反应的化学方程式为:4NH3+O2
4NO+6H2O;
故答案为:4NH3+O2
4NO+6H2O;
②在制取硝酸过程中,氨气催化氧化生成一氧化氮和水,一氧化氮和氧气 反应生成二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,可以循环使用的物质为NO;氨气通入硝酸中,反应后产物为硝酸铵,是两种化合价,结构中含有的化学键类型为离子键和共价键;
故答案为:NO;离子键和共价键;
③铜与稀硝酸反应生成硝酸铜,一氧化氮和水,反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(3)①加热氮肥样品生成两种气体,其中一种气体能使湿润的红色石蕊试纸变蓝,该气体为氨气,说明含有铵根离子,另一种气体能使澄清石灰水变浑浊,说明碳酸根离子或碳酸氢根离子;②取少量该氮肥样品溶于水,并加入少量BaCl2溶液,没有明显变化,说明没有碳酸氢根离子,说明盐中含有铵根离子和碳酸根离子,所以氮肥的主要成分NH4HCO3,氮肥的溶液与足量NaOH溶液在加热条件下反应的离子方程式为:NH4++HCO3-+2OH-=NH3↑+CO32-+2H2O;
故答案为:NH4HCO3;NH4++HCO3-+2OH-=NH3↑+CO32-+2H2O.
②碳酸铵加热分解产生氨气、水和二氧化碳,化学方程式为:(NH4)2CO3
| ||
| ||
(2)①氨发生催化氧化反应生成一氧化氮和水,反应的化学方程式为:4NH3+O2
| ||
| △ |
故答案为:4NH3+O2
| ||
| △ |
②在制取硝酸过程中,氨气催化氧化生成一氧化氮和水,一氧化氮和氧气 反应生成二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,可以循环使用的物质为NO;氨气通入硝酸中,反应后产物为硝酸铵,是两种化合价,结构中含有的化学键类型为离子键和共价键;
故答案为:NO;离子键和共价键;
③铜与稀硝酸反应生成硝酸铜,一氧化氮和水,反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(3)①加热氮肥样品生成两种气体,其中一种气体能使湿润的红色石蕊试纸变蓝,该气体为氨气,说明含有铵根离子,另一种气体能使澄清石灰水变浑浊,说明碳酸根离子或碳酸氢根离子;②取少量该氮肥样品溶于水,并加入少量BaCl2溶液,没有明显变化,说明没有碳酸氢根离子,说明盐中含有铵根离子和碳酸根离子,所以氮肥的主要成分NH4HCO3,氮肥的溶液与足量NaOH溶液在加热条件下反应的离子方程式为:NH4++HCO3-+2OH-=NH3↑+CO32-+2H2O;
故答案为:NH4HCO3;NH4++HCO3-+2OH-=NH3↑+CO32-+2H2O.
点评:本题考查了氨气制取、性质分析,实验过程分析判断,主要是工业生产过程和原理的理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
要增大铁与盐酸反应的速率,所采取的下列措施中无效的是( )
| A、用铁粉代替铁片 |
| B、增大压强 |
| C、提高反应的温度 |
| D、增大盐酸的浓度 |
美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是( )
| A、合金的熔点一般比组分金属低 |
| B、铝钠合金若投入一定量的水中可得无色溶液,则n(Al)≤n(Na) |
| C、铝钠合金投入到足量氯化铜溶液中,会有氢氧化铜沉淀也可能有铜析出 |
| D、若m g不同组成的铝钠合金投入足量盐酸中,放出的H2越多,则铝的质量分数越小 |
 现有8种元素,它们的原子序数依次增大,其中A、B、C、D、E为短周期主族元素,F、G、H为第四周期元素.请根据下列相关信息,回答问题.
现有8种元素,它们的原子序数依次增大,其中A、B、C、D、E为短周期主族元素,F、G、H为第四周期元素.请根据下列相关信息,回答问题.