题目内容
16.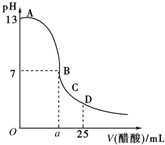 25℃时,在25mL 0.1mol/L的NaOH溶液中,逐滴加入0.2mol/L的CH3COOH溶液,溶液的pH变化如下图所示,下列分析的结论中正确的是( )
25℃时,在25mL 0.1mol/L的NaOH溶液中,逐滴加入0.2mol/L的CH3COOH溶液,溶液的pH变化如下图所示,下列分析的结论中正确的是( )| A. | B点的横坐标a=12.5 | |
| B. | C点时溶液中有:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | D点时溶液中有:c(CH3COO-)+c(CH3COOH)=2c(Na+) | |
| D. | 曲线上A、B间的任意一点,溶液中都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
分析 A.当氢氧化钠和醋酸恰好反应时,消耗醋酸的体积是12.5ml,醋酸是弱酸,由于醋酸钠的水解溶液显碱性,B点的pH=7,说明醋酸溶液应稍过量;
B.根据电荷守恒c(CH3COO-)+c(OH-)=c(H+)+c(Na+);
C.D点溶液是等浓度的醋酸钠和醋酸的混合液,根据原子守恒(微粒守恒)判断;
D.若加入的醋酸很少时,会有c(Na+)>c(OH-)>c(CH3COO-)>c(H+).
解答 解:A.醋酸是弱酸,当氢氧化钠和醋酸恰好反应时,消耗醋酸的体积是12.5ml,此时由于醋酸钠的水解溶液显碱性,即pH大于7.B点的pH=7,说明醋酸溶液的体积应大于12.5ml,故A错误;
B.根据电荷守恒c(CH3COO-)+c(OH-)=c(H+)+c(Na+),选项中电荷不可能守恒,故B错误;
C.D点溶液中的溶质是醋酸钠和醋酸的混合液,且二者的浓度相同,所以根据原子守恒(微粒守恒)可知:c(CH3COO-)+c(CH3COOH)=2c(Na+),故C正确;
D.若加入的醋酸很少时,会有c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故D错误.
故选:C.
点评 本题考查离子浓度大小比较,注意根据弱电解质电离、盐类水解以及电荷守恒、物料守恒、质子恒等式进行比较判断.

练习册系列答案
相关题目
4.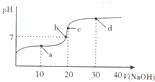 室温时,向20mL0.1mol•L-1的醋酸溶液中不断滴人0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )
室温时,向20mL0.1mol•L-1的醋酸溶液中不断滴人0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )
 室温时,向20mL0.1mol•L-1的醋酸溶液中不断滴人0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )
室温时,向20mL0.1mol•L-1的醋酸溶液中不断滴人0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )| A. | a点时:c( CH3COOH)>c( Na+)>c( CH3COO-)>c( H+)>c( OH -) | |
| B. | b点时:c( Na+)=c( CH3COO-)>c(H+)=c( OH-) | |
| C. | c点时:c(H+)=c(CH3COOH)+c( OH-) | |
| D. | d点时:c(Na+)>c(CH3COO -)>c(OH-)>c(H+) |
11.常温时,向pH=2的硫酸溶液中加入等体积的下列溶液后,滴入甲基橙试液,出现红色,该溶液可能是( )
| A. | pH=12的Ba(OH)2 | B. | pH=12的NH3•H2O | ||
| C. | 0.05 mol/L的NaOH | D. | 0.05 mol/L的BaCl2 |
1.常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
(1)从甲组情况分析,(填“能”或“不能”)不能判断HA是强酸还是弱酸.
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)相等,则乙组混合溶液中存在3个动态平衡.
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+ )>c(A- )>c( OH-)>c( H+)
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)=10-4-10-10mol•L-1
(5)用离子方程式解释丁溶液pH=10的原因是A-+H2O?HA+OH-.
| 实验编号 | HA的物质的量 浓度(mol•L-1) | NaOH的物质的量 浓度(mol•L-1) | 混合后 溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)相等,则乙组混合溶液中存在3个动态平衡.
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+ )>c(A- )>c( OH-)>c( H+)
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)=10-4-10-10mol•L-1
(5)用离子方程式解释丁溶液pH=10的原因是A-+H2O?HA+OH-.
5.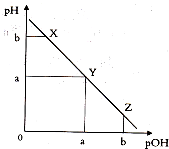 某温度下,向一定体积0.1mol.L一1氨水溶液中逐滴加入等浓度的盐酸,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如图所示.下列说法不正确是( )
某温度下,向一定体积0.1mol.L一1氨水溶液中逐滴加入等浓度的盐酸,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如图所示.下列说法不正确是( )
 某温度下,向一定体积0.1mol.L一1氨水溶液中逐滴加入等浓度的盐酸,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如图所示.下列说法不正确是( )
某温度下,向一定体积0.1mol.L一1氨水溶液中逐滴加入等浓度的盐酸,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如图所示.下列说法不正确是( )| A. | 此温度下,水的离子积常数为1.0×l0-2a | |
| B. | X点和Z点所示溶液中H2O的电离程度相同 | |
| C. | X、Y、Z三点所示的溶液中:c(NH4+)+c(H+)═c(Cl-)+c(OH-) | |
| D. | Y点消耗盐酸的体积等于氨水的体积 |
6.已知四种主族元素的离子aWm+、bXn+、cYm-、dZn-具有相同的电子层结构,下列说法正确的是( )
| A. | 若m>n,金属性W>X | |
| B. | 若m>n,气态氢化物的稳定性HmY>HnZ | |
| C. | 若m<n,氧化性Xn+>Wm+ | |
| D. | 若m<n,原子序数a>b>c>d |
 某研究性学习小组为了证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤如下:
某研究性学习小组为了证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤如下: