题目内容
固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg(NO2)2、NO2、O2
乙:MgO、NO2、O2
丙:Mg3N2、O2
丁:MgO、NO2、N2
(1)实验小组成员经讨论认定猜想丁不成立,理由是_______________________。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O
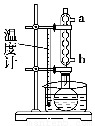
针对甲、乙、丙猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):

(2)实验过程
①仪器连接后,放入固体试剂之前,关闭k,微热硬质玻璃管(A),观察到E中有气泡连续放出,表明__________。
②称取Mg(NO3)2固体3.7 g置于A中,加热前通入N2以驱尽装置内的空气,其目的是________;关闭k,用酒精灯加热时,正确操作是先________,然后固定在管中固体部位下加热。
③观察到A中有红棕色气体出现,C、D中未见明显变化。
④待样品完全分解,A装置冷却至室温、称量,测得剩余固体的质量为1.0 g。
⑤取少量剩余固体于试管中,加入适量水,未见明显现象。
(3)实验结果分析讨论
①根据实验现象和剩余固体的质量经分析可初步确认猜想______是正确的。
②根据D中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应:______________(填写化学方程式),溶液颜色会褪去;小组讨论认定分解产物中有O2存在,未检测到的原因是__________
____________________________________________________。
③小组讨论后达成的共识是上述实验设计仍不完善,需改进装置进一步探究。
(1)不符合氧化还原反应原理(或其他合理答案)(2)①装置气密性良好 ②避免对产物O2的检验产生干扰(或其他合理答案)移动酒精灯预热硬质玻璃管
(3)①乙 ②2Na2SO3+O2=2Na2SO4 O2在通过装置B时已参与反应(或其他合理答案)
【解析】 (1)丁产物中只有N的化合价降低,没有化合价升高的,不符合电子守恒规律。(2)在做有关气体多步连续实验时,首先应检查装置的气密性,还要考虑装置中的空气对产物的生成及检验是否会产生影响,若有干扰必须先排净干扰气体。对玻璃加热时要先均匀预热,再集中加热。(3)①不可能是甲,因为甲中Mg(NO2)2可溶于水。不可能是丙,因为丙中Mg3N2能与水反应产生NH3和Mg(OH)2沉淀。
只能是乙, Mg(NO3)2 ~ MgO
148 40
3.7 g m
m=40× =1.0 g
=1.0 g
氧化镁难溶于水,且符合质量变化。
②Na2SO3具有还原性,能被O2氧化;NO2和O2可被NaOH共同吸收。

 阅读快车系列答案
阅读快车系列答案