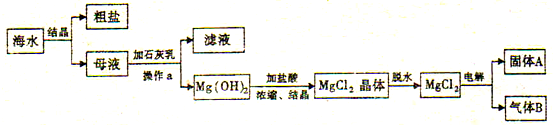
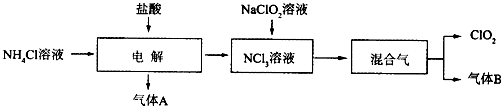
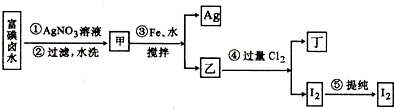
题目内容
12.下列判断正确的是( )| A. | 原子半径:S>O>N | B. | 沸点:H2O>HF>H2S | ||
| C. | 离子半径:Cl->Al3+>Mg2+ | D. | 还原性:I->S2->Br- |
分析 A.原子电子层数越多其原子半径越大,同一周期元素原子半径随着原子序数增大而减小;
B.氢化物的熔沸点随着相对分子质量增大而增大,但含有氢键的熔沸点较高;
C.离子电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
D.元素的非金属性越弱,其简单阴离子的还原性越强.
解答 解:A.原子电子层数越多其原子半径越大,同一周期元素原子半径随着原子序数增大而减小,所以原子半径S>N>O,故A错误;
B.氢化物的熔沸点随着相对分子质量增大而增大,但含有氢键的熔沸点较高,水和HF中都含有氢键,但常温下水是液体、HF是气体,沸点:H2O>HF>H2S,故B正确;
C.离子电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径:Cl->Mg2+>Al3+,故C错误;
D.元素的非金属性越弱,其简单阴离子的还原性越强,非金属性Br>I>S,所以还原性:S2->I->Br-,故D错误;
故选B.
点评 本题考查元素周期律应用,为高频考点,明确同一周期、同一主族元素性质递变规律是解本题关键,易错选项是B,注意氢化物的稳定性与化学键有关,但氢化物的稳定性与分子间作用力有关.

练习册系列答案
相关题目
7.有关氯的叙述正确的是( )
| A. | 液氯和氯水是同一物质 | |
| B. | 红磷在氯气中燃烧产生红色烟雾 | |
| C. | 氯气与水的反应中氯是氧化剂,水是还原剂 | |
| D. | 用氯制漂白粉是为了得到易贮存的漂白剂 |
4.要使含有Ag+、Mg2+、Ba2+等溶液中的离子逐一形成沉淀析出,下列所选择的试剂及加入试剂的顺序正确的是( )
| A. | H2SO4→HCl→NaOH→CO2 | B. | Na2SO4→NaCl→NH3•H2O | ||
| C. | NaCl→Na2SO4→NaOH | D. | Na2SO4→NaCl→NaOH |
1.电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.下列说法正确的是( )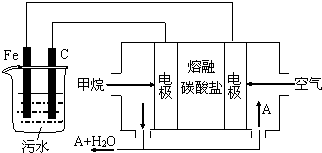

| A. | 该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,则负极的电极反应是CH4+4CO32--8e-═5CO2+2H2O | |
| B. | 实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣,此时,可以向污水中加入适量的稀H2SO4 | |
| C. | 实验过程中,若阴极产生2mol气体,则燃料电池消耗11.2L CH4 | |
| D. | 为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A参加循环,则A物质是CO32- |
2.下列各组物质全部是弱电解质的是( )
| A. | H2SiO3.H2S CO2 | |
| B. | H2O NH3•H2O HClO.HF | |
| C. | H2SO3 Ba(OH)2 BaSO4 | |
| D. | Cu(OH)2 CH3COOH C2H5OH CH3COONa |