题目内容
5.测得某溶液中含Cu2+,K+,SO42-,Cl-四种离子且阳离子的个数比为:N(Cu2+):N(K+)=3:4,则SO42-与Cl-的物质的量之比可能是( )| A. | 3:2 | B. | 1:3 | C. | 1:8 | D. | 2:5 |
分析 由溶液中两种阳离子的个数比为Cu2+:K+=3:4,若Cu2+的个数为3个,则K+为4个;根据溶液中阴阳离子所带电荷总数相等,计算溶液中SO42-与Cl-的物质的量之比.
解答 解:设Cu2+和K+个数分别为3和4则所带正电荷总数为10个,所以负电荷总数也必须为10个,将答案分别代入如果SO42-:Cl-的比值为1:3或1:8时负电荷总数都能达到10个.
故选BC.
点评 本题考查溶液中离子的相关计算,为高频考点,侧重于学生的分析能力的考查,依据溶液中阴阳离子所带电荷总数相等、电性相反,因此整个溶液不显电性进行计算.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.某无色溶液中存在大量的NH4+、H+、SO42-,该溶液中还可能大量存在的离子是( )
| A. | Cu2+ | B. | Al3+ | C. | CH3COO- | D. | HCO3- |
13.下列化学用语中,正确的是( )
| A. | 氯化钠的电子式为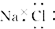 | |
| B. | 镁的原子结构示意图为 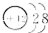 | |
| C. | 氯化氢分子的形成过程可用电子式表示式: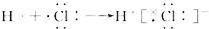 | |
| D. | 重水的化学式为${\;}_{1}^{2}$H2O(或D2O) |
20.某无色透明溶液中存在大量的H+、Cl-、NO${\;}_{3}^{-}$,该溶液中还可能大量存在的是( )
| A. | HCO${\;}_{3}^{-}$ | B. | Cu2+ | C. | NH${\;}_{4}^{+}$ | D. | Ag+ |
10.某元素价电子构型3d54S2,是该元素是( )
| A. | Fe | B. | Co | C. | Mn | D. | Ni |
14.下列关于氯气的说法错误的是( )
| A. | 是一种有强烈刺激性气味的气体 | B. | 可用于自来水消毒 | ||
| C. | 与氢氧化钠溶液反应可制成漂白液 | D. | 能使干燥的红色布条褪色 |
15.${\;}_{6}^{13}$C-NMR(核磁共振)可用于含碳化合物的结构分析,${\;}_{6}^{13}$C表示的含义错误的是( )
| A. | 表示碳元素的一种原子 | |
| B. | 质量数是13,原子序数是6,核内有7个质子 | |
| C. | 表示碳元素的一种核素 | |
| D. | 质量数是13,原子序数是6,核内有7个中子 |
 .
. .
.