题目内容
14.下列关于氯气的说法错误的是( )| A. | 是一种有强烈刺激性气味的气体 | B. | 可用于自来水消毒 | ||
| C. | 与氢氧化钠溶液反应可制成漂白液 | D. | 能使干燥的红色布条褪色 |
分析 A.氯气是一种具有刺激性气味的有毒气体;
B.氯气通入水中生成盐酸和次氯酸,次氯酸具有强氧化性;
C.氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水为漂白液;
D.氯气无漂白性,氯气和水反应生成的次氯酸具有漂白性.
解答 解:A.氯气为黄绿色有刺激性气味的气体,故A正确;
B.次氯酸具有强氧化性,可用于自来水消毒,氯气通入水中生成盐酸和次氯酸,故B正确;
C.制成漂白液利用氯气和氢氧化钠溶液反应生成,故C正确;
D.氯气能使湿润的红色布条褪色,干燥的氯气不能使干燥的红色布条褪色,故D错误;
故选D.
点评 本题考查氯气的性质,为元素化合物知识的高频考点,有利于培养学生的良好的科学素养和学习的积极性,注意相关基础知识的积累,题目难度不大.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
15.在一定温度下,体积不变的密闭容器中,发生可逆反应N2(g)+3H2(g)?2NH3(g),下列说法中正确的是( )
| A. | 若向密闭容器中再充入N2,则反应速率减慢 | |
| B. | 若反应前10s时,H2减少了0.3mol,则v(H2)=0.03mol•L-1•s-1 | |
| C. | 若某时刻N2、H2、NH3的浓度不再发生变化,则表明该反应达到了平衡状态 | |
| D. | 若某时刻消耗了1molN2同时生成了2molNH3,则表明该反应达到了平衡状态 |
5.测得某溶液中含Cu2+,K+,SO42-,Cl-四种离子且阳离子的个数比为:N(Cu2+):N(K+)=3:4,则SO42-与Cl-的物质的量之比可能是( )
| A. | 3:2 | B. | 1:3 | C. | 1:8 | D. | 2:5 |
9.下列各选项均有X、Y两种物质,将X缓缓滴入(通入)Y溶液中,无论X是否过量,均能用同一离子方程式表示的是( )
| A. | X-稀盐酸,Y-碳酸钠溶液 | B. | X-偏铝酸钠溶液,Y-硫酸溶液 | ||
| C. | X-硫化氢气体,Y-氯化铁溶液 | D. | X-二氧化碳,Y-偏铝酸钠溶液 |
3.某元素的最外层有 2 个电子,该元素( )
| A. | 一定是金属元素 | B. | 一定是稀有气体 | ||
| C. | 一定是ⅡA 族元素 | D. | 无法确定属于哪类元素 |
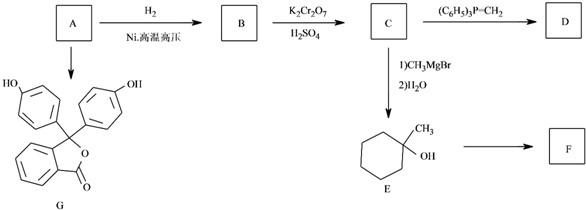
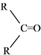 $\stackrel{(C_{6}H_{5})_{3}P=CH_{2}}{→}$
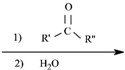
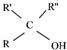
$\stackrel{(C_{6}H_{5})_{3}P=CH_{2}}{→}$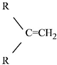 (R表示烃基,R′和R″表示烃基或基)
(R表示烃基,R′和R″表示烃基或基) .
. 、
、 .
. .
.
 .
. .
.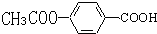
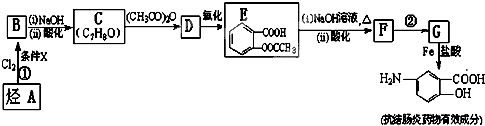
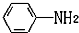 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物 的合成路线
的合成路线 .(仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
.(仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题) 和
和
 和
和