题目内容
13.下列化学用语中,正确的是( )| A. | 氯化钠的电子式为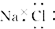 | |
| B. | 镁的原子结构示意图为 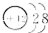 | |
| C. | 氯化氢分子的形成过程可用电子式表示式: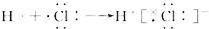 | |
| D. | 重水的化学式为${\;}_{1}^{2}$H2O(或D2O) |
分析 A.氯化钠为离子化合物,氯离子应该加上中括号;
B.镁原子核外电子总数为12,最外层为2个电子;
C.氯化氢为共价化合物,氯化氢中不存在阴阳离子,电子式中不能标出电荷;
D.重水中氢原子为D原子,重氢原子的质量数为2.
解答 解:A.氯化钠属于离子化合物,电子式中阴阳离子需要标出原子的最外层电子,氯化钠正确的电子式为: ,故A错误;
,故A错误;
B.镁的原子结构示意图为 ,故B错误;
,故B错误;
C.氯化氢属于共价化合物,分子中不存在阴阳离子,用电子式表示氯化氢的形成过程为: ,故C错误;
,故C错误;
D.重水分子中的氢原子为重氢原子,重氢的质量数为2,则重水的化学式为:${\;}_{1}^{2}$H2O(或D2O),故D正确;
故选D.
点评 本题考查了电子式、原子结构示意图、用电子式表示形成过程、化学式等知识,题目难度不大,注意掌握常见化学用语的概念及表示方法,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案
相关题目
15.在一定温度下,体积不变的密闭容器中,发生可逆反应N2(g)+3H2(g)?2NH3(g),下列说法中正确的是( )
| A. | 若向密闭容器中再充入N2,则反应速率减慢 | |
| B. | 若反应前10s时,H2减少了0.3mol,则v(H2)=0.03mol•L-1•s-1 | |
| C. | 若某时刻N2、H2、NH3的浓度不再发生变化,则表明该反应达到了平衡状态 | |
| D. | 若某时刻消耗了1molN2同时生成了2molNH3,则表明该反应达到了平衡状态 |
8.废电池伴着生活垃圾将是人类环境的新公害.下列哪种组合中的元素均是废电池中所含的有害元素( )
| A. | Hg、Pb、C、Na | B. | Cu、K、S、P | C. | Hg、Pb、Mn、Ni | D. | Br、N、Pb、As |
5.测得某溶液中含Cu2+,K+,SO42-,Cl-四种离子且阳离子的个数比为:N(Cu2+):N(K+)=3:4,则SO42-与Cl-的物质的量之比可能是( )
| A. | 3:2 | B. | 1:3 | C. | 1:8 | D. | 2:5 |
3.某元素的最外层有 2 个电子,该元素( )
| A. | 一定是金属元素 | B. | 一定是稀有气体 | ||
| C. | 一定是ⅡA 族元素 | D. | 无法确定属于哪类元素 |
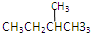 和
和
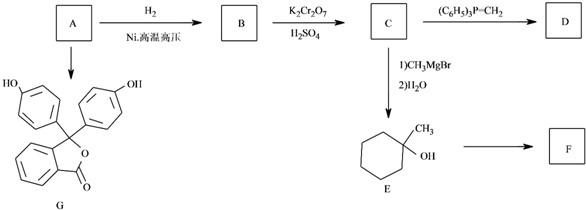
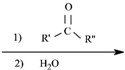
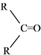 $\stackrel{(C_{6}H_{5})_{3}P=CH_{2}}{→}$
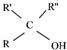
$\stackrel{(C_{6}H_{5})_{3}P=CH_{2}}{→}$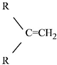 (R表示烃基,R′和R″表示烃基或基)
(R表示烃基,R′和R″表示烃基或基) .
. 、
、 .
. .
.