题目内容
10.某元素价电子构型3d54S2,是该元素是( )| A. | Fe | B. | Co | C. | Mn | D. | Ni |
分析 价电子构型为3d54s2的元素,根据构造原理写出其电子排布式,判断电子数和质子数,然后确定属于哪种元素.
解答 解:价电子构型为3d54s2的元素,根据构造原理写出其电子排布式为:1s22s22p63s23p63d54s2,则其电子数为25,所以质子数为25,即为Mn元素,
故选C.
点评 本题考查原子结构与位置关系、元素周期表等,难度不大,注意理解核外电子排布规律.

练习册系列答案
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
11.下列反应的离子方程式书写正确的是( )
| A. | 氯化铁溶液与碘化钾溶液反应:Fe3++2I-═Fe2++I2 | |
| B. | 硫酸溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 氯化镁溶液与过量氨水反应:Mg2++2NH3•H2O═Mg (OH)2↓+2NH4+ |
5.测得某溶液中含Cu2+,K+,SO42-,Cl-四种离子且阳离子的个数比为:N(Cu2+):N(K+)=3:4,则SO42-与Cl-的物质的量之比可能是( )
| A. | 3:2 | B. | 1:3 | C. | 1:8 | D. | 2:5 |
15.锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]3d104s24p2,有2个未成对电子.
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键.从原子结构角度分析,原因是Ge原子半径大,原子间形成的σ单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键.
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因GeCl4、GeBr4、GeI4的熔、沸点依次增高.原因是分子结构相似,分子量依次增大,分子间相互作用力逐渐增强.
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂.Zn、Ge、O电负性由大至小的顺序是O>Ge>Zn.
(5)①Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为sp3,微粒之间存在的作用力是共价键.
②已知Ge单晶的晶胞的边长为565.76pm,其密度为$\frac{8×73}{6.02×1{0}^{23}×(565.76×1{0}^{-10})^{3}}$g•cm-3(列出计算式即可,阿伏加德罗常数用NA表示,Ge的相对原子质量为73).
(1)基态Ge原子的核外电子排布式为[Ar]3d104s24p2,有2个未成对电子.
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键.从原子结构角度分析,原因是Ge原子半径大,原子间形成的σ单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键.
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因GeCl4、GeBr4、GeI4的熔、沸点依次增高.原因是分子结构相似,分子量依次增大,分子间相互作用力逐渐增强.
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
(5)①Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为sp3,微粒之间存在的作用力是共价键.
②已知Ge单晶的晶胞的边长为565.76pm,其密度为$\frac{8×73}{6.02×1{0}^{23}×(565.76×1{0}^{-10})^{3}}$g•cm-3(列出计算式即可,阿伏加德罗常数用NA表示,Ge的相对原子质量为73).
 和
和



 $\stackrel{(C_{6}H_{5})_{3}P=CH_{2}}{→}$
$\stackrel{(C_{6}H_{5})_{3}P=CH_{2}}{→}$ (R表示烃基,R′和R″表示烃基或基)
(R表示烃基,R′和R″表示烃基或基) .
. 、
、 .
. .
.
 .
. .
.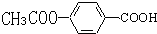
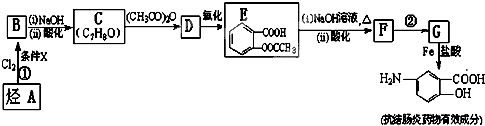
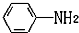 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物 的合成路线
的合成路线 .(仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
.(仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题)