题目内容
16.现有一种铝和镁的混合物样品.某学生分别取0.9g此样品进行四次反应,并收集标准状况的氢气.有关数据记录如下表:| 实验序号 | 固体质量 | 加入某浓度盐酸的体积/mL | 加入某浓度NaOH的体积/mL | 收集到气体体积/mL |
| 1 | 0.9 | 20.0 | ─ | 1008 |
| 2 | 0.9 | 30.0 | ─ | 1008 |
| 3 | 0.9 | ─ | 20.0 | 672 |
| 4 | 0.9 | ─ | 30.0 | 672 |
(2)请计算固体中铝、镁的物质的量.
分析 根据实验1、2可知0.9g合金与盐酸完全反应最多生成1008mL氢气,根据实验3、4可知0.9g合金与氢氧化钠溶液反应最多生成672mL氢气,其中3、4的反应中,镁不与氢氧化钠溶液反应,只有铝反应,据此可计算出铝的物质的量、质量,从而可知合金中镁的质量,据此进行解答.
解答 解:(1)Al和NaOH溶液反应生成NaAlO2和H2,反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)根据实验3、4生成氢气的体积相等可知,氢氧化钠溶液是过量的,生成氢气的物质的量为:$\frac{0.672L}{22.4L/mol}$=0.03mol,根据反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知合金中含有铝的物质的量为:0.03mol×$\frac{2}{3}$=0.02mol,质量为:27g/mol×0.02mol=0.54g,
则0.90g合金中镁的质量为:0.90g-0.54g=0.36g,物质的量为:$\frac{0.36g}{24g/mol}$=0.015mol,
答:每份样品中含有0.02mol铝、0.015mol镁.
点评 本题考查了混合物反应的计算,题目难度中等,根据实验3、4判断氢氧化钠溶液过量为解答关键,注意掌握物质的量与摩尔质量、气体摩尔体积之间的关系,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.将质量分数为20%的氨水与等体积的水混合,得到的混合溶液的质量分数为( )
| A. | 10% | B. | 大于10% | C. | 小于10% | D. | 无法确定 |
4.下列叙述中正确的是( )
| A. | 摩尔是把物质的质量和微观粒子数联系起来的一个基本物理量 | |
| B. | 1摩尔H2SO4的质量为98g/mol | |
| C. | 国际上规定,0.012 kg 碳原子所含有的碳原子数目为 1 mol | |
| D. | 1摩尔氢气分子可以表示为1mol H2 |
11.下列物质或指定物质主要成分与化学式对应正确的是( )
| A. | 明矾--Al2(SO4)3•12H2O | B. | 漂白粉--NaClO | ||
| C. | 苏打粉--NaHCO3 | D. | 水煤气--CO、H2 |
1.在xR2++yH++O2═mR3++nH2O的离子方程式中,对系数m和R3+的判断正确的是( )
| A. | m=4 R2+是还原剂 | B. | m=n R3+是氧化产物 | ||
| C. | m=2 R2+是氧化剂 | D. | m=y R3+是还原产物 |
8.向30mL 1mol•L-1的AlCl3溶液中逐渐加入浓度为4mol•L-1的NaOH溶液,若产生0.78g白色沉淀,则加入的NaOH溶液的体积可能为( )
| A. | 3 mL | B. | 7.5 mL | C. | 15 mL | D. | 22.5 mL |
5.事实上,许多非金属氧化物在一定条件下能与Na2O2反应,且反应极有规律.如:Na2O2+SO2→Na2SO4、Na2O2+SO3→Na2SO4+O2,据此,你认为下列方程式中不正确的是( )
| A. | 2Na2O2+2Mn2O7→4NaMnO4+O2↑ | B. | 2Na2O2+P2O3→Na4P2O7 | ||
| C. | 2Na2O2+2 N2O3→NaNO2+O2↑ | D. | 2 Na2O2+2 N2O5→4NaNO3+O2↑ |
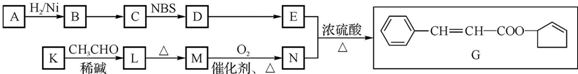
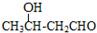
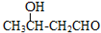 $\stackrel{△}{→}$CH3CH=CHCHO+H2O
$\stackrel{△}{→}$CH3CH=CHCHO+H2O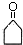 .
. .
.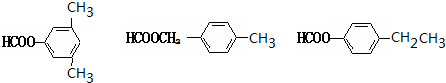 (其中两种).
(其中两种).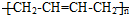 ).请设计合成路线(其他无机原料任选)并用如下方式表示:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物HOCH2CH2CH2CH3$→_{△}^{浓H_{2}SO_{4}}$CH2=CHCH2CH3$\stackrel{NBS}{→}$CH2=CHCHBrCH3$→_{△}^{氢氧化钠醇溶液}$CH2=CHCH=CH2$\stackrel{催化剂}{→}$
).请设计合成路线(其他无机原料任选)并用如下方式表示:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物HOCH2CH2CH2CH3$→_{△}^{浓H_{2}SO_{4}}$CH2=CHCH2CH3$\stackrel{NBS}{→}$CH2=CHCHBrCH3$→_{△}^{氢氧化钠醇溶液}$CH2=CHCH=CH2$\stackrel{催化剂}{→}$