题目内容
6.若7.2g某元素组成的气体在标准状况时的体积是3.36L,已知该元素的相对原子质量是16,则该气体每个分子中所含原子的个数为( )| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
分析 先根据n=$\frac{V}{{V}_{m}}$计算出标准状况下3.36L该气体的物质的量,然后根据M=$\frac{m}{n}$计算出该气体的摩尔质量,从而可知该气体的相对分子量,然后结合该元素的相对原子质量计算出该气体每个分子中所含原子的个数.
解答 解:标准状况时的体积3.36L该气体的物质的量为:$\frac{3.36L}{22.4L/mol}$=0.15mol,
该气体分子的摩尔质量为:$\frac{7.2g}{0.15mol}$=48g/mol,该气体的相对分子质量为48,
已知该元素的相对原子质量是16,则该气体每个分子中所含原子的个数为:$\frac{48}{16}$=3,
故选C.
点评 本题考查了物质的量相关计算,题目难度不大,明确摩尔质量与相对分子质量之间的关系巍峨解答关键,注意熟练掌握物质的量与气体摩尔体积、摩尔质量之间的关系,试题培养了学生的化学计算能力.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
16.现有一种铝和镁的混合物样品.某学生分别取0.9g此样品进行四次反应,并收集标准状况的氢气.有关数据记录如下表:
(1)请写出固体与NaOH溶液反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(2)请计算固体中铝、镁的物质的量.
| 实验序号 | 固体质量 | 加入某浓度盐酸的体积/mL | 加入某浓度NaOH的体积/mL | 收集到气体体积/mL |
| 1 | 0.9 | 20.0 | ─ | 1008 |
| 2 | 0.9 | 30.0 | ─ | 1008 |
| 3 | 0.9 | ─ | 20.0 | 672 |
| 4 | 0.9 | ─ | 30.0 | 672 |
(2)请计算固体中铝、镁的物质的量.
14.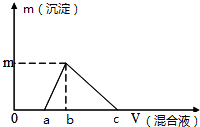 往100mL0.1mol/L NaOH溶液中逐滴滴入浓度均为0.1mol/L的氯化铝和盐酸的混合溶液,测得生成沉淀的质量(g)与滴入的混合液的体积(mL)的关系如图所示,则下列说法正确的是( )
往100mL0.1mol/L NaOH溶液中逐滴滴入浓度均为0.1mol/L的氯化铝和盐酸的混合溶液,测得生成沉淀的质量(g)与滴入的混合液的体积(mL)的关系如图所示,则下列说法正确的是( )
 往100mL0.1mol/L NaOH溶液中逐滴滴入浓度均为0.1mol/L的氯化铝和盐酸的混合溶液,测得生成沉淀的质量(g)与滴入的混合液的体积(mL)的关系如图所示,则下列说法正确的是( )
往100mL0.1mol/L NaOH溶液中逐滴滴入浓度均为0.1mol/L的氯化铝和盐酸的混合溶液,测得生成沉淀的质量(g)与滴入的混合液的体积(mL)的关系如图所示,则下列说法正确的是( )| A. | a=25mL | B. | b=33mL | C. | c=100mL | D. | m=0.195g |
1.在一定条件下,PbO2与浓盐酸反应,产物是Cl2和Pb2+,则生成0.1mol Cl2所需PbO2的物质的量为( )
| A. | 0.3mol | B. | 0.15mol | C. | 0.1mol | D. | 0.075mol |
11.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 一定条件下,1mol N2与足量H2混合反应生成NH3,转移电子数6NA | |
| B. | 在常温常压下,2.8g N2和CO的混合气体所含电子数为1.4NA | |
| C. | 标准状况下,22.4L CCl4含有的分子数目为NA | |
| D. | 在电解精炼粗铜的过程中,当转移电子数为NA时,阳极溶解32g |
18.乙醇燃料电池是一种绿色的生物燃料电池.其工作原理如图所示.下列有关说法不正确的是( )
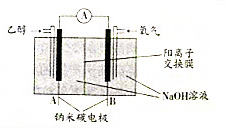

| A. | A极为电池负极,B极为电池正极 | |
| B. | B极的电极反应式为O2+2H2O+4e-═4OH- | |
| C. | 该乙醇燃料电池的总反应方程式为:C2H5OH+3O2═2CO2+3H2O | |
| D. | 当电池消耗4.6g乙醇时,经过阴离子交换膜的OH-为1.2mol |
8.100mL 6mol•L-1的硫酸溶液跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,又不影响生成氢气的总量,可向反应物中加入适量的( )
| A. | Na2CO3固体 | B. | 3 mol•L-1的H2SO4溶液 | ||
| C. | CH3COOK溶液 | D. | KNO3溶液 |