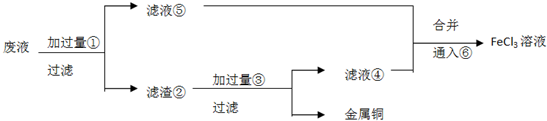
题目内容
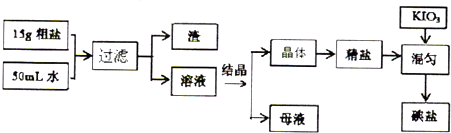
食用加碘盐的生产流程如图所示:
(1)检验母液中是否含有SO42-离子的方法是 .
(2)过滤时,用到的玻璃仪器有: 、 、 .
(3)国家标准GB546061-92规定碘盐含碘量(以碘计):出厂产品≥40mg/Kg;销售品≥30mg/Kg.某次实验时向一干净的坩埚中放入5g精盐,加入1mL0.001mol/L标准KIO3溶液搅拌均匀,在100℃恒温烘干1h,即得碘盐产品,该碘盐的含碘量约为 mg/Kg(保留一位小数),是否为合格产品 (选填“合格”或“不合格”).
(4)检验碘盐是否加有碘酸钾,定性检验方法是在酸性介质中加还原剂KCNS,其反应如下:6IO3-+5CNS-+H++2H2O→3I2+5HCN+5SO42-,检验时,除需用KCNS外,还需要使用的一种试剂是 .
(5)使用碘盐时,要防止高温,是因为:①碘盐中的碘酸钾在560℃开始分解产生无色气体,剩余固体中加硝酸酸化的硝酸银溶液有黄色沉淀生成:②碘盐在热水中,也会反应生成两种单质,其中一种是无色气体,在反应后的溶液中滴加酚酞试液显红色.根据以上信息写出①、②中发生反应的化学方程式:① ;② .

(1)检验母液中是否含有SO42-离子的方法是
(2)过滤时,用到的玻璃仪器有:
(3)国家标准GB546061-92规定碘盐含碘量(以碘计):出厂产品≥40mg/Kg;销售品≥30mg/Kg.某次实验时向一干净的坩埚中放入5g精盐,加入1mL0.001mol/L标准KIO3溶液搅拌均匀,在100℃恒温烘干1h,即得碘盐产品,该碘盐的含碘量约为
(4)检验碘盐是否加有碘酸钾,定性检验方法是在酸性介质中加还原剂KCNS,其反应如下:6IO3-+5CNS-+H++2H2O→3I2+5HCN+5SO42-,检验时,除需用KCNS外,还需要使用的一种试剂是
(5)使用碘盐时,要防止高温,是因为:①碘盐中的碘酸钾在560℃开始分解产生无色气体,剩余固体中加硝酸酸化的硝酸银溶液有黄色沉淀生成:②碘盐在热水中,也会反应生成两种单质,其中一种是无色气体,在反应后的溶液中滴加酚酞试液显红色.根据以上信息写出①、②中发生反应的化学方程式:①
考点:物质分离和提纯的方法和基本操作综合应用,物质的分离、提纯和除杂,物质的检验和鉴别的基本方法选择及应用,探究物质的组成或测量物质的含量
专题:实验设计题
分析:15g粗盐溶于50ml水中过滤除去不溶性杂质,得到的溶液蒸发结晶得到氯化钠晶体加入碘酸钾混均得到碘盐;
(1)在检验SO42-时,加入氯化钡之前要先加盐酸以排除CO32-离子的干扰;
(2)过滤时,用到的玻璃仪器有漏斗、玻璃棒、烧杯;
(3)根据碘盐的含碘量=
进行计算判断;
(4)反应生成碘,淀粉遇碘变蓝;
(5)根据碘盐中的碘酸钾在560℃开始分解产生无色气体即氧气,剩余固体加硝酸酸化的硝酸银有黄色沉淀说明有碘离子产生据此书写.
(1)在检验SO42-时,加入氯化钡之前要先加盐酸以排除CO32-离子的干扰;
(2)过滤时,用到的玻璃仪器有漏斗、玻璃棒、烧杯;
(3)根据碘盐的含碘量=
| m(碘) |
| m(总) |
(4)反应生成碘,淀粉遇碘变蓝;
(5)根据碘盐中的碘酸钾在560℃开始分解产生无色气体即氧气,剩余固体加硝酸酸化的硝酸银有黄色沉淀说明有碘离子产生据此书写.
解答:
解:(1)在检验SO42-时,加入氯化钡之前要先加盐酸以排除CO32-离子的干扰.即先加盐酸酸化,无现象,再加氯化钡溶液,出现白色沉淀,说明含有SO42-,
故答案为:取少量母液先加入稀盐酸酸化,再加入BaCl2溶液,若有白色沉淀,则说明有SO42-离子;
(2)过滤时,用到的玻璃仪器有漏斗、玻璃棒、烧杯,故答案为:漏斗;玻璃棒;烧杯;
(3)根据碘盐的含碘量=
=
=25.4mg/Kg,故答案为:25.4;不合格;
(4)反应生成碘,淀粉遇碘变蓝,则检验时,除需用KCNS外,还需要的一种试剂最好是淀粉,
故答案为:淀粉溶液;
(5)根据碘盐中的碘酸钾在560℃开始分解产生无色气体即氧气,剩余固体加硝酸酸化的硝酸银有黄色沉淀说明有碘离子产生,所以方程式为2KIO3
2KI+3O2↑,碘盐在热水中,也会反应生成两种单质,其中一种是无色气体,在反应后的溶液中滴加酚酞试液显红色说明生成碱,所以判断单质为碘单质和氧气,反应的化学方程式为12KIO3+6H2O
6I2+12KOH+15O2↑,
答案为:2KIO3
KI+3O2↑;12KIO3+6H2O
6I2+12KOH+15O2↑.
故答案为:取少量母液先加入稀盐酸酸化,再加入BaCl2溶液,若有白色沉淀,则说明有SO42-离子;
(2)过滤时,用到的玻璃仪器有漏斗、玻璃棒、烧杯,故答案为:漏斗;玻璃棒;烧杯;
(3)根据碘盐的含碘量=
| m(碘) |
| m(总) |
| 1×10-3×0.001×127×10-3mg |
| 5×10-3Kg |
(4)反应生成碘,淀粉遇碘变蓝,则检验时,除需用KCNS外,还需要的一种试剂最好是淀粉,
故答案为:淀粉溶液;
(5)根据碘盐中的碘酸钾在560℃开始分解产生无色气体即氧气,剩余固体加硝酸酸化的硝酸银有黄色沉淀说明有碘离子产生,所以方程式为2KIO3
| ||
| ||
答案为:2KIO3
| ||
| ||
点评:本题考查制取碘盐的流程,涉及硫酸根的检验、实验操作及计算等,侧重分析能力、知识迁移应用能力的综合考查,题目难度中等.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
用已知浓度盐酸滴定未知浓度的NaOH溶液时,下列操作使测定结果(NaOH溶液的浓度)偏高的是( )
| A、滴定达终点时,俯视读数 |
| B、碱液移入锥形瓶后,加入10mL蒸馏水 |
| C、酸式滴定管用蒸馏水洗涤后,未用标准液润洗 |
| D、滴定振荡锥形瓶过程中,有少量溶液溅出 |
以下实验操作或方法不正确的是( )
A、 闻气体的气味 |
B、 用浓硫酸 |
C、 向容量瓶中转移液体 |
D、 过滤 |
如果定义有机物的同系列是一系列结构式符合 (其中n=0、1、2、3…)的化合物.式中A、B是任意一种基团(或氢原子),W为2价的有机基团,又称为该同系列的系差.同系列化合物的性质往往呈现规律性变化.下列四组化合物中,不可称为同系列的是( )
(其中n=0、1、2、3…)的化合物.式中A、B是任意一种基团(或氢原子),W为2价的有机基团,又称为该同系列的系差.同系列化合物的性质往往呈现规律性变化.下列四组化合物中,不可称为同系列的是( )
 (其中n=0、1、2、3…)的化合物.式中A、B是任意一种基团(或氢原子),W为2价的有机基团,又称为该同系列的系差.同系列化合物的性质往往呈现规律性变化.下列四组化合物中,不可称为同系列的是( )
(其中n=0、1、2、3…)的化合物.式中A、B是任意一种基团(或氢原子),W为2价的有机基团,又称为该同系列的系差.同系列化合物的性质往往呈现规律性变化.下列四组化合物中,不可称为同系列的是( )| A、CH3CH2CH2CH3 CH3CH2CH2CH2CH3 CH3CH2CH2CH2CH2CH3 |
| B、CH3CH=CHCHO CH3CH=CHCH=CHCHO CH3(CH=CH)3CHO |
| C、CH3CH2CH3 CH3CHClCH2CH3 CH3CHClCH2CHClCH3 |
| D、ClCH2CHClCCl3 ClCH2CHClCH2CHClCCl3 ClCH2CHClCH2CHClCH2CHClCCl3 |
下列实验操作中错误的是( )
| A、用丁达尔效应区别FeCl3溶液与Fe(OH)3胶体 |
| B、可用加热分解的方法区别Na2CO3和NaHCO3固体 |
| C、分液时,先将分液漏斗中上层液体从上口倒出,再将下层液体从下口放出 |
| D、蒸馏时,温度计水银球靠近蒸馏烧瓶的支管口处,且冷却水从冷凝管的下口通入上口流出 |