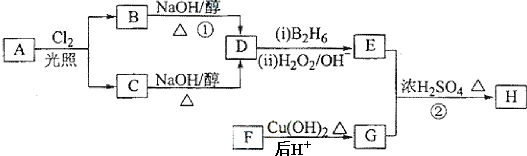
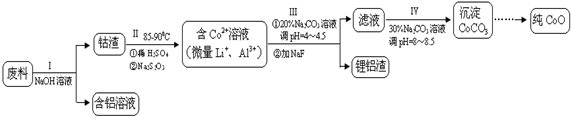
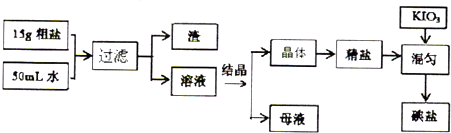
题目内容
100mL0.5mol?L-1的Al3+溶液加OH-,若产生沉淀的质量为1.56克,则消耗了0.1mol?L-1的NaOH溶液体积为 .
考点:离子方程式的有关计算
专题:
分析:n(Al3+)=0.1L×0.5mol/L=0.05mol,若Al元素都转化为氢氧化铝沉淀,则生成氢氧化铝沉淀为0.05mol,而实际生成1.56g氢氧化铝,1.56g Al(OH)3沉淀的物质的量为
=0.02mol<0.05mol,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,结合方程式计算消耗氢氧化钠物质的量,进而计算需要氢氧化钠溶液体积.
| 1.56g |
| 78g/mol |
解答:
解:n(Al3+)=0.1L×0.5mol/L=0.05mol,若Al元素都转化为氢氧化铝沉淀,则生成氢氧化铝沉淀为0.05mol,而实际生成1.56g氢氧化铝,1.56g Al(OH)3沉淀的物质的量为
=0.02mol<0.05mol,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,NaOH的物质的量为0.02mol×3=0.06mol,加入NaOH溶液的体积为
=0.6L,
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,则:
Al3++3OH-═Al(OH)3↓
0.05mol 0.15mol 0.05mol
溶解氢氧化铝的物质的量为0.05mol-0.02mol=0.03mol,
Al(OH)3+OH-═AlO2-+2H2O
0.03mol 0.03mol
则消耗的碱的物质的量为0.15mol+0.03mol=0.18mol,
加入NaOH溶液的体积为
=1.8L,
故答案为:0.6L或1.8L.
| 1.56g |
| 78g/mol |
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,NaOH的物质的量为0.02mol×3=0.06mol,加入NaOH溶液的体积为
| 0.06mol |
| 0.1mol/L |
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,则:
Al3++3OH-═Al(OH)3↓
0.05mol 0.15mol 0.05mol
溶解氢氧化铝的物质的量为0.05mol-0.02mol=0.03mol,
Al(OH)3+OH-═AlO2-+2H2O
0.03mol 0.03mol
则消耗的碱的物质的量为0.15mol+0.03mol=0.18mol,
加入NaOH溶液的体积为
| 0.18mol |
| 0.1mol/L |
故答案为:0.6L或1.8L.
点评:本题考查化学方程式的有关计算,关键是根据氯化铝与氢氧化铝的量判断发生的反应,再结合反应的有关方程式计算,题目难度中等.

练习册系列答案
相关题目
以下各组均有三种溶液,这三种溶液中所含溶质的物质的量均相等,将它们充分混合后不会产生沉淀的是( )
| A、AlCl3,Ba(OH)2,HCl |
| B、BaCl2,Na2CO3,NaCl |
| C、MgCl2,NaOH,HNO3 |
| D、NaAlO2,NaOH,H2SO4 |
为达到预期的实验目的,下列操作正确的是( )
| A、预制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 |
| B、用碘的水溶液鉴别乙醇、四氯化碳 |
| C、欲配制质量分数为10%的CuSO4溶液,将10gCuSO4?5H2O溶解在90g水中 |
| D、某同学用托盘天平称量5.85gNaCl固体 |