题目内容
14.下列说法中正确的是( )| A. | 1molC质量是12 g•mol-1 | |
| B. | 22.4L H2的物质的量是1mol | |
| C. | 将60gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度是1.5mol•L-1 | |
| D. | NaCl的摩尔质量是58.5 g•mol-1 |
分析 A.质量的单位为g,g/mol为摩尔质量的单位;
B.没有告诉在标准状况下,不能使用标准状况下的气体摩尔体积;
C.将60gNaOH溶于1L水中,所得溶液的体积不是1L;
D.氯化钠的相对分子量为58.5,结合相对分子质量与摩尔质量的关系判断.
解答 解:A.1molC的质量为:12g/mol×1mol=12g,故A错误;
B.不是标准状况下,题中数据无法计算氢气的物质的量,故B错误;
C.将60gNaOH溶于1L水中,所得溶液体积不是1L,所得溶液的浓度不是1.5mol/L,故C错误;
D.NaCl的相对分子质量为58.5,则其摩尔质量是58.5 g•mol-1,故D正确;
故选D.
点评 本题考查了物质的量的计算,题目难度不大,明确标准状况下气体摩尔体积的使用条件为解答关键,注意掌握物质的量与摩尔质量、气体摩尔体积之间的关系为解答关键,C为易错点,注意水的体积不等于溶液体积.

练习册系列答案
相关题目
4.从人类利用金属的历史看,先是青铜器时代,而后是铁器时代,铝的利用是近百年的事,造成这个先后顺序事实的最主要因素是( )
| A. | 地壳中金属元素的含量 | B. | 金属的延展性 | ||
| C. | 金属的导电性 | D. | 金属活动性及冶炼的难易程度 |
5.下列化学反应既属于氧化还原反应又属于四种基本反应类型的是( )
| A. | Cu+2FeCl3═CuCl2+2FeCl2 | |
| B. | 2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | |
| C. | Cl2+2KI═2KCl+I2 | |
| D. | 2CuSO4+2H2O $\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑ |
2.下列离子反应方程式正确的是( )
| A. | 将铜插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| B. | Ca( HCO3)2 溶液与过量 NaOH 溶液反应:HCO3-+OH-+Ca2+═CaCO3↓+H2O | |
| C. | 用食醋除水垢:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| D. | 稀硫酸和Ba(OH)2溶液反应:H++SO42-+Ba 2++OH-═BaSO 4↓+H2O |
9.在25℃时,密闭容器中X、Y、Z三种气体的起始浓度和平衡浓度如表,下列说法错误的是( )
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 反应可表示为X+3Y?2Z,平衡常数为1600 | |
| C. | 其他条件不变时,增大压强可使平衡常数增大 | |
| D. | 改变温度可以改变该反应的平衡常数 |
4.利用工厂的废铁屑(含少量Fe2O3、SiO2、锡等),制备绿矾(FeSO4•7H2O)的过程如下:
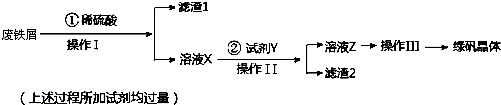
已知:①室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.
②溶液X加KSCN不显红色.
(1)操作I的名称为过滤,所需玻璃仪器为烧杯、漏斗、玻璃棒.
(2)操作III的顺序依次为:加热蒸发、冷却结晶、过滤、洗涤、干燥.
(3)操作 II 中,试剂 Y 是H2S,然后用稀硫酸将溶液酸化至 pH=2 的目的是除去溶液中的Sn2+离子,并防止Fe2+离子生成沉淀.
(4)写出绿矾与酸性高锰酸钾溶液反应的离子方程式MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O.
(5)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至 pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失.
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠.通过计算,分析和比较上表3组数据,给出结论.

已知:①室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.
②溶液X加KSCN不显红色.
(1)操作I的名称为过滤,所需玻璃仪器为烧杯、漏斗、玻璃棒.
(2)操作III的顺序依次为:加热蒸发、冷却结晶、过滤、洗涤、干燥.
(3)操作 II 中,试剂 Y 是H2S,然后用稀硫酸将溶液酸化至 pH=2 的目的是除去溶液中的Sn2+离子,并防止Fe2+离子生成沉淀.
(4)写出绿矾与酸性高锰酸钾溶液反应的离子方程式MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O.
(5)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至 pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失.
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
11.实验:①0.1mol/L AgNO3溶液和0.1mol/L NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;②向滤液b中滴加0.1mol/L KI溶液,出现浑浊;③向沉淀c中滴加0.1mol/L KI溶液,沉淀变为黄色.下列分析不正确的是( )
| A. | 浊液a中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq) | |
| B. | 滤液b中不含有Ag+ | |
| C. | ③中颜色变化说明AgCl转化为AgI | |
| D. | 实验可以证明AgI比AgCl更难溶 |
8.温度为T时,向2.0L恒容密闭容器中充入1.0molPCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经一段时间后达到平衡.反应过程中测定的部分数据见下表:
下列说法不正确的是( )
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50 s的平均速率为v(PCl3)=0.0016mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11mol•L-1,则反应的△H>0 | |
| C. | 相同温度下,起始时向容器中充入1.0 molPCl5、0.20 molPCl3和0.20 molCl2,达到平衡前v(正)>v(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0 molPCl3、2.0 molCl2,达到平衡时,PCl3的转化率小于80% |