题目内容
准确移取25.00mL某未知浓度的盐酸溶液于一洁净锥形瓶中,然后用0.20mol/L NaOH溶液滴定(指示剂为酚酞).滴定结果如下:
(1)根据以上数据可计算出盐酸的物质的量浓度为 mol/L(精确到0.01).
(2)锥形瓶用蒸留水洗涤后,水朱倒尽,则滴定时用去NaOH标准溶液的体积 (顺“偏大”、“偏小”或“无偏”).
(3)滴定时边滴边摇动锥形瓶,眼睛应观察 .
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(4)达到滴定终点的标志是 .
(5)若操作有误,则导致待测盐酸溶液浓度偏低的错误操作是 (填序号).
A.滴定管用蒸馏水洗后未用标准碱液润洗,直接装入标准碱液
B.滴定前滴定管尖端有气泡,滴定后气泡消失
C.滴定管读数时,滴定前仰视滴定后俯视
D.待测液中指示剂酚酞(为有机弱酸)加得太多
(6)如果准确移取25.00mL 0.20mol/L NaOH溶液于锥形瓶中,滴入甲基橙指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度? (填“是”或“否”)
| NaOH溶液起始读数 | NaOH溶液终点读数 | |
| 第一次 | 0.10mL | 18.60mL |
| 第二次 | 0.20mL | 18.50mL |
(2)锥形瓶用蒸留水洗涤后,水朱倒尽,则滴定时用去NaOH标准溶液的体积
(3)滴定时边滴边摇动锥形瓶,眼睛应观察
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(4)达到滴定终点的标志是
(5)若操作有误,则导致待测盐酸溶液浓度偏低的错误操作是
A.滴定管用蒸馏水洗后未用标准碱液润洗,直接装入标准碱液
B.滴定前滴定管尖端有气泡,滴定后气泡消失
C.滴定管读数时,滴定前仰视滴定后俯视
D.待测液中指示剂酚酞(为有机弱酸)加得太多
(6)如果准确移取25.00mL 0.20mol/L NaOH溶液于锥形瓶中,滴入甲基橙指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度?
考点:中和滴定
专题:实验题
分析:(1)先判断数据的合理性,然后NaOH溶液的平均体积,然后根据HCl~NaOH求盐酸的物质的量浓度;
(3)根锥形瓶用蒸留水洗涤后,水未倒尽,待测液的物质的量不变;
(2)根据酚酞的变色范围来确定;
(3)实验中应控制流速并观察锥形瓶中颜色变化;
(4)如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(5)根据c(待测)=
,分析不当操作对V(标准)的影响,以此判断浓度的误差;
(6)根据关系式HCl~NaOH来计算出盐酸的浓度.
(3)根锥形瓶用蒸留水洗涤后,水未倒尽,待测液的物质的量不变;
(2)根据酚酞的变色范围来确定;
(3)实验中应控制流速并观察锥形瓶中颜色变化;
(4)如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(5)根据c(待测)=
| C(标准)×V(标准) |
| V(待测) |
(6)根据关系式HCl~NaOH来计算出盐酸的浓度.
解答:
解:(1)两次消耗的NaOH溶液的体积为18.50mL,18.30mL,均有效,盐酸溶液的平均体积为18.40mL
HCl~NaOH
1 1
C(HCl)×25.00mL 0.20mol/L×18.40mL
解得:C(HCl)=0.1472 mol/L,故答案为:0.1472;
(2)锥形瓶用蒸留水洗涤后,水未倒尽,待测液的物质的量不变,则滴定时用去NaOH标准溶液的体积不变;
故答案为:无偏;
(3)滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶中颜色变化,以判断滴定终点;
故答案为:B;
(4)根据反应结束前,溶液为无色,反应结束时无色变浅红色且半分钟内不褪色;
故答案为:无色变浅红色且半分钟内不褪色;
(5)A.滴定管用蒸馏水洗后未用标准碱液润洗,直接装入标准碱液,标准碱液被稀释,浓度偏小,造成V(标准)偏大,根据c(待测)=
,可知C(标准)偏大,故A错误;
B.滴定前滴定管尖端有气泡,滴定后气泡消失,造成成V(标准)偏大,根据c(待测)=
,可知C(标准)偏大,故B错误;
C.滴定管读数时,滴定前仰视滴定后俯视,造成成V(标准)偏小,根据c(待测)=
,可知C(标准)偏小,故C正确;
D.待测液中指示剂酚酞(为有机弱酸)加得太多,造成V(标准)偏大,根据c(待测)=
,可知C(标准)偏大,故D错误;
故选C;
(6)准确移取20.00mL 0.1000mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,通过盐酸的体积,根据HCl~NaOH来计算出盐酸的浓度;
故答案为:是.
HCl~NaOH
1 1
C(HCl)×25.00mL 0.20mol/L×18.40mL
解得:C(HCl)=0.1472 mol/L,故答案为:0.1472;
(2)锥形瓶用蒸留水洗涤后,水未倒尽,待测液的物质的量不变,则滴定时用去NaOH标准溶液的体积不变;
故答案为:无偏;
(3)滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶中颜色变化,以判断滴定终点;
故答案为:B;
(4)根据反应结束前,溶液为无色,反应结束时无色变浅红色且半分钟内不褪色;
故答案为:无色变浅红色且半分钟内不褪色;
(5)A.滴定管用蒸馏水洗后未用标准碱液润洗,直接装入标准碱液,标准碱液被稀释,浓度偏小,造成V(标准)偏大,根据c(待测)=
| C(标准)×V(标准) |
| V(待测) |
B.滴定前滴定管尖端有气泡,滴定后气泡消失,造成成V(标准)偏大,根据c(待测)=
| C(标准)×V(标准) |
| V(待测) |
C.滴定管读数时,滴定前仰视滴定后俯视,造成成V(标准)偏小,根据c(待测)=
| C(标准)×V(标准) |
| V(待测) |
D.待测液中指示剂酚酞(为有机弱酸)加得太多,造成V(标准)偏大,根据c(待测)=
| C(标准)×V(标准) |
| V(待测) |
故选C;
(6)准确移取20.00mL 0.1000mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,通过盐酸的体积,根据HCl~NaOH来计算出盐酸的浓度;
故答案为:是.
点评:本题考查酸碱中和滴定实验,题目难度不大,注意把握实验的原理、步骤、方法以及注意事项,把握实验基本操作.

练习册系列答案
相关题目
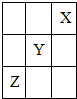 短周期元素X,Y,Z在周期表中的位置如图所示,则下列说法中错误的是( )
短周期元素X,Y,Z在周期表中的位置如图所示,则下列说法中错误的是( )| A、X,Y,Z中X的单质最稳定 |
| B、Y的氢化物为HY |
| C、Y与水反应能生成HYO |
| D、Z的最高价氧化物的水化物是强酸 |
下列各组物质,前者属于电解质,后者属于非电解质的是( )
| A、NaCl晶体、BaSO4 |
| B、铜、二氧化硫 |
| C、硫酸、酒精 |
| D、熔融的KNO3、硫酸溶液 |

