题目内容
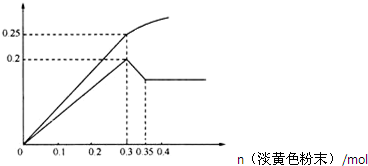
有一无色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示,请回答:
(1)淡黄色粉末为 (填名称).其电子式为
(2)溶液中肯定没有 离子.
(3)溶液中离子的物质的量之比为 .
(4)①淡黄色粉末与水反应的化学方程式为 ,②沉淀部分减少时的离子方程式为 .

(1)淡黄色粉末为
(2)溶液中肯定没有
(3)溶液中离子的物质的量之比为
(4)①淡黄色粉末与水反应的化学方程式为
考点:常见离子的检验方法,常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:根据实验现象判断Fe3+、Cu2+、NH4+是否存在,根据图象判断Mg2+、Al3+是否存在,根据生成沉淀的情况和消耗的过氧化钠的情况来确定各个离子的量的多少以及产生气体的量的多少,氢氧化镁不溶于氢氧化钠,但是氢氧化铝可以溶于氢氧化钠,根据过氧化钠中的化学键情况来书写电子式.
解答:
解:(1)淡黄色粉末是过氧化钠,是含有钠离子和过氧根离子的离子化合物,电子式为 ,
,
故答案为:过氧化钠; ;
;
(2)溶液时无色透明,排除铁离子和铜离子,首先加入过氧化钠与水反应,2Na2O2+2H2O=4NaOH+O2↑,当加入过氧化钠时,生成白色沉淀,推断一定有Mg2+,通过图象知,在加入过量的过氧化钠的过程中,沉淀部分溶解,推断一定含有Al3+,氢氧化镁不溶于强碱,氢氧化铝是两性氢氧化物,可以溶于强碱,最终的白色沉淀的成分是氢氧化镁,根据加入过氧化钠的量的增加生成气体的量会变化,所以产生的气体应含有除氧气以外的一种气体,即为氨气,一定含有铵根离子,
故答案为:Fe3+、Cu2+;
(3)加入过氧化钠与水反应,2Na2O2+2H2O=4NaOH+O2↑,在0.3-0.35mol这一段内,共溶解氢氧化铝沉淀0.1mol,则根据Al3+~Al(OH)3~[Al(OH)4]-,所以铝离子的物质的量是0.1mol,造0~0.3mol过氧化钠这一段,生成沉淀量最大,是氢氧化镁和氢氧化铝的混合物,所以含有氢氧化镁也是0.1mol,根据Mg2+~Mg(OH)2,所以镁离子的物质的量是0.1mol,根据气体的量,当加入0.3mol过氧化钠时,理论上会产生0.15mol的氧气,此时生成气体共0.25mol,所以会生成0.1mol的氨气,根据NH4+~NH3↑,铵根离子的物质的量为:0.1mol,所以各种离子浓度只比是1:1:1,故答案为:n(Mg2+):n(NH4+):n(Al3+)=1:1:1;
(4)过氧化钠和水反应的方程式为:2Na2O2+2H2O═4NaOH+O2↑,氢氧化镁和氢氧化钠不反应,但是氢氧化铝可以和氢氧化钠发生反应,沉淀部分减少时的离子方程式为Al(OH)3+OH-═AlO2-+2H2O,故答案为:2Na2O2+2H2O═4NaOH+O2↑;Al(OH)3+OH-═AlO2-+2H2O.
 ,
,故答案为:过氧化钠;
 ;
;(2)溶液时无色透明,排除铁离子和铜离子,首先加入过氧化钠与水反应,2Na2O2+2H2O=4NaOH+O2↑,当加入过氧化钠时,生成白色沉淀,推断一定有Mg2+,通过图象知,在加入过量的过氧化钠的过程中,沉淀部分溶解,推断一定含有Al3+,氢氧化镁不溶于强碱,氢氧化铝是两性氢氧化物,可以溶于强碱,最终的白色沉淀的成分是氢氧化镁,根据加入过氧化钠的量的增加生成气体的量会变化,所以产生的气体应含有除氧气以外的一种气体,即为氨气,一定含有铵根离子,
故答案为:Fe3+、Cu2+;
(3)加入过氧化钠与水反应,2Na2O2+2H2O=4NaOH+O2↑,在0.3-0.35mol这一段内,共溶解氢氧化铝沉淀0.1mol,则根据Al3+~Al(OH)3~[Al(OH)4]-,所以铝离子的物质的量是0.1mol,造0~0.3mol过氧化钠这一段,生成沉淀量最大,是氢氧化镁和氢氧化铝的混合物,所以含有氢氧化镁也是0.1mol,根据Mg2+~Mg(OH)2,所以镁离子的物质的量是0.1mol,根据气体的量,当加入0.3mol过氧化钠时,理论上会产生0.15mol的氧气,此时生成气体共0.25mol,所以会生成0.1mol的氨气,根据NH4+~NH3↑,铵根离子的物质的量为:0.1mol,所以各种离子浓度只比是1:1:1,故答案为:n(Mg2+):n(NH4+):n(Al3+)=1:1:1;
(4)过氧化钠和水反应的方程式为:2Na2O2+2H2O═4NaOH+O2↑,氢氧化镁和氢氧化钠不反应,但是氢氧化铝可以和氢氧化钠发生反应,沉淀部分减少时的离子方程式为Al(OH)3+OH-═AlO2-+2H2O,故答案为:2Na2O2+2H2O═4NaOH+O2↑;Al(OH)3+OH-═AlO2-+2H2O.
点评:本题考查的是常见阳离子的检验,注意各个离子的性质,结合图象的方式考查增加了难度,本题综合性很强,难度很大.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
分子式C4H8O2的有机物与硫酸溶液共热可得有机物A和B.将A氧化最终可得C,且B和C为同系物.若B可发生斐林反应,则原有机物的结构简式为( )
| A、HCOOCH2CH2CH3 |
| B、CH3COOCH2CH3 |
| C、CH3CH2COOCH3 |
| D、HOCH2CH2CH2CHO |
某溶液中有Fe3+、Mg2+、Fe2+和Na+四种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量盐酸,溶液中大量增加的阳离子是( )
| A、Fe3+ |
| B、Mg2+ |
| C、Na+ |
| D、Fe2+ |
鉴别NaOH、Na2CO3、Ba(OH)2三种溶液,最好选用下列试剂中的( )
| A、石蕊溶液 |
| B、稀盐酸 |
| C、稀硫酸 |
| D、CaCl2溶液 |