题目内容
12.反应:4(NH4)2SO4 ═N2↑+6NH3↑+3SO2↑+SO3 ↑+7H2O,当转移12mol电子,下列说法正确的是( )| A. | 有12mol(NH4)2SO4分解 | B. | 有6mol原子被还原 | ||
| C. | 生成2mol氧化产物 | D. | 生成7molH2O |
分析 4(NH4)2SO4=N2↑+6NH3↑+3SO2↑+SO3↑+7H2O反应中,N元素的化合价由-3价升高为0,S元素的化合价由+6价降低为+4,该反应转移6e-,结合化合价的变化来解答.
解答 解:A.12mol电子转移时8mol(NH4)2SO4分解,故A错误;
B.12mol电子转移时8mol(NH4)2SO4分解,6molS原子被还原,故B正确;
C.氮气为氧化产物,12mol电子转移时8mol(NH4)2SO4分解,生成2molN2,故C正确;
D.6mol电子转移时生成7mol水,则当有12mol电子转移时,生成14mollH2O,故D错误;
故选BC.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意转移电子及物质的量的关系,题目难度不大..

练习册系列答案
相关题目
2.化合物A是一种新型锅炉水除氧剂,其结构式如图所示,下列说法中正确的是( )
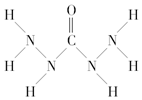

| A. | A中氧元素非金属性最强,故只有氧元素显负价 | |
| B. | 由A中的四种元素组成的化合物可能是离子化合物 | |
| C. | A分子中存在两类共价键 | |
| D. | A分子中氮原子没有孤电子对而氧原子有 |
3.下列关于钠的化合物的说法中,正确的是( )
| A. | Na2CO3和NaHCO3均能与盐酸和NaOH溶液反应 | |
| B. | NaHCO3固体中混有的Na2CO3可用加热的方法除去 | |
| C. | Na2O2和Na2O中阴阳离子个数比均为1:2 | |
| D. | 分别向Na2O2和Na2O与水反应后的溶液中立即滴入酚酞溶液,现象相同 |
20.在无色透明的强酸性溶液中,能大量共存的离子组是( )
| A. | K+、Na+、NO3-、MnO4- | B. | Mg2+、Na+、Cl-、SO42- | ||
| C. | K+、Cu2+、Br-、S2- | D. | NH4+、Al3+、Ac-、NO3- |
7.中华民族有着光辉灿烂的发明史,下列发明创造不涉及氧化还原反应的是( )
| A. | 用胆矾炼铜 | B. | 打磨磁石制指南针 | ||
| C. | 黑火药的使用 | D. | 用铁矿石炼铁 |
17.不属于合金的物质是 ( )
| A. | 生铁 | B. | 硬铝 | C. | 水银 | D. | 青铜 |
4.在元素周期表中,在金属元素和非金属元素分界线附近能找到( )
| A. | 制半导体材料的元素 | B. | 制催化剂的元素 | ||
| C. | 制农药的元素 | D. | 制耐高温合金的元素 |
1.下列物质属于碱的是( )
| A. | KCl | B. | Cu2(OH)2CO3 | C. | Na2CO3 | D. | NaOH |
7.下列化合物中,属于碱的是( )
| A. | MgO | B. | SO2 | C. | H2SO4 | D. | Ca(OH)2 |