题目内容
7.中华民族有着光辉灿烂的发明史,下列发明创造不涉及氧化还原反应的是( )| A. | 用胆矾炼铜 | B. | 打磨磁石制指南针 | ||
| C. | 黑火药的使用 | D. | 用铁矿石炼铁 |
分析 有电子转移的化学反应是氧化还原反应,其特征是有元素化合价的变化,据此分析.
解答 解:A.用胆矾炼铜,Cu的化合价从+2价降低到0价,所以涉及氧化还原反应,故A不选;
B.打磨磁石制指南针,属于物理变化,不是化学变化,不涉及氧化还原反应,故B选;
C.黑火药的使用时,发生了剧烈的爆炸,C、S、N等元素的化合价发生变化,涉及氧化还原反应,故C不选;
D.用铁矿石炼铁,Fe元素的化合价降低,铁矿石被还原,属于氧化还原反应,故D不选;
故选B.
点评 本题考查氧化还原反应、化学工业原理,明确各工业生成原理是解本题关键,难度不大,侧重于考查了学生对基础知识的应用能力.

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
17.化学与生产、生活、社会密切相关.下列有关说法中不正确的是( )
| A. | 在日常生活中,电化腐蚀是造成钢铁腐蚀的主要原因 | |
| B. | 明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒 | |
| C. | SO2具有漂白性,可用于漂白纸浆,但不可以用于漂白食品 | |
| D. | 纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污 |
18.下列溶液中的Cl-浓度与100mL 1mol•L-1 MgCl2溶液中的Cl-浓度相等的是( )
| A. | 200 mL 1 mol•L-1 KCl溶液 | B. | 50 mL 2 mol•L-1CaCl2溶液 | ||
| C. | 150 mL 2 mol•L-1 NaCl溶液 | D. | 50 mL 1 mol•L-1AlCl3溶液 |
15.在密闭容器中进行反应:X(g)+3Y(g)?2Z(g),有关下列图象的说法正确的是( )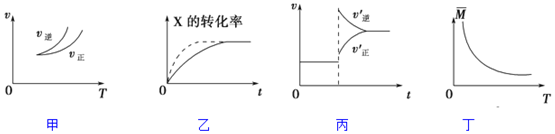

| A. | 依据图甲可判断正反应为吸热反应 | |
| B. | 在图乙中,虚线可表示压强增大 | |
| C. | 若正反应的△H<0,图丙可表示升高温度使平衡向逆反应方向移动 | |
| D. | 由图丁中气体平均相对分子质量随温度的变化情况,可推知正反应的△H>0 |
2.可用如图装置制取(必要时可加热)、净化、收集的气体是( )
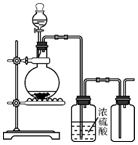

| A. | 铜和稀硝酸制一氧化氮 | B. | 亚硫酸钠与硫酸制二氧化硫 | ||
| C. | 锌和稀硫酸制氢气 | D. | 硫化亚铁与稀硫酸制硫化氢 |
12.反应:4(NH4)2SO4 ═N2↑+6NH3↑+3SO2↑+SO3 ↑+7H2O,当转移12mol电子,下列说法正确的是( )
| A. | 有12mol(NH4)2SO4分解 | B. | 有6mol原子被还原 | ||
| C. | 生成2mol氧化产物 | D. | 生成7molH2O |
19.有关铝的用途是利用铝的化学性质的是( )
| A. | 高压铝锅 | B. | 焊接钢轨 | C. | 铝制导线 | D. | 包装铝箔 |
16.能用离子方程式H++OH-=H2O表示的反应是( )
| A. | 硝酸和氢氧化钠 | B. | 盐酸和氢氧化镁 | C. | 醋酸和氢氧化钾 | D. | 硫酸和氢氧化钡 |
2.下列说法正确的是( )
| A. | 在由水电离产生的氢离子浓度为10-13 mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3-四种离子能大量共存 | |
| B. | 已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)=6.82×10-6 | |
| C. | 常温下,将0.2 mol?L-1某一元碱(ROH)溶液和0.1 mol?L-1HCl溶液等体积混合,混合后溶液pH<7,则c(ROH)>c(R+) | |
| D. | 对于反应N2H4(l)=N2(g)+2H2(g),△H=-50.6 kJ?mol-1,它只在高温下自发进行 |