题目内容
13. 污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.
污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.实验仪器
I.实验原理:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O.
Ⅱ.实验设计
(1)【方案】观察反应现象:在其它相同条件下,测定不同浓度H2C2O4溶液与等体积等浓度KMnO4
溶液混合后,溶液褪色所需的时间.拟定实验数据:
| 实验序号 | 温度/℃ | 各物质的体积/mL | 反应时间 | |||
| H2O | 3mol/L稀硫酸 | 0.1mol/L KMnO4溶液 | 0.6mol/LH2C2O4溶液 | |||
| 1 | 25 | 3.0 | 2.0 | 4.0 | 6.0 | t1 |
| 2 | ① | 5.0 | 2.0 | 4.0 | 4.0 | t2 |
| 3 | 25 | ② | 2.0 | 4.0 | 2.0 | t3 |
III.讨论与交流
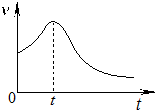
(2)小组同学在处理一系列的实验数据时,发现速率(v)-时间(t)曲线如图所示.他们认为:0~t时间内,速率变快的可能原因是①产物Mn2+是反应的催化剂、②该反应放热使温度升高.
(3)实验室常用KMnO4标准溶液滴定某浓度草酸.
KMnO4溶液置于酸式滴定管(填仪器名称)中,判断到达滴定终点的现象是溶液由无色变为浅紫红色,且半分钟内不褪色.若读取滴定管数据时,起始读数正确,终点俯视读数,则测定结果偏低(填“偏高”、“偏低”、“无影响”).
分析 (1)在相同温度下,测定不同浓度H2C2O4溶液与等体积等浓度KMnO4溶液混合后溶液褪色所需的时间,实验时溶液的体积相同,反应温度应该相同;
(2)从影响化学反应速率的因素主要有温度、浓度、压强和催化剂考虑;
(3)高锰酸钾具有腐蚀性,应放在酸式滴定管中,达到滴定终点时,溶液由无色变为红色,若读取滴定管数据时,起始读数正确,终点俯视读数,导致所读体积偏小.
解答 解:(1)在相同温度下,测定不同浓度H2C2O4溶液与等体积等浓度KMnO4溶液混合后,溶液褪色所需的时间,实验时溶液的体积相同,H2C2O4的浓度不同,则①应为25℃,由1、2数据可知溶液总体积为15mL,则②为7.0mL,
故答案为:25;7.0;
(2)影响化学反应速率的因素主要有温度、浓度、压强和催化剂,反应为放热反应,温度升高,且生成的锰离子对反应可能起到催化作用,都可加快反应速率,随着反应的进行,浓度逐渐降低,此时反应速率又减小,
故答案为:①产物Mn2+是反应的催化剂、②该反应放热使温度升高;
(3)高锰酸钾具有腐蚀性,应放在酸式滴定管中,达到滴定终点时,溶液由无色变为红色,若读取滴定管数据时,起始读数正确,终点俯视读数,导致所读体积偏小,即需要的高锰酸钾的体积偏小,则测定的浓度偏低,
故答案为:酸式滴定管;溶液由无色变为浅紫红色,且半分钟内不褪色;偏低.
点评 本题考查化学反应速率的影响因素的探究,为高频考点,侧重于学生的分析能力和实验能力的考查,有利于培养学生的良好的科学素养,难度中等

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
4.下列有关钠的叙述中错误的是( )
| A. | 钠具有强还原性 | |
| B. | 金属钠可以保存在煤油中 | |
| C. | 钠的密度比水小 | |
| D. | 钠与硫酸铜溶液反应,可以置换出铜 |
1.某有机物的结构简式如图,下列关于该有机物的叙述中不正确的是( )


| A. | 1 mol 该有机物与 NaOH 溶液完全反应时,消耗 1 mol NaOH | |
| B. | 该有机物水解所得产物能发生酯化反应 | |
| C. | 该有机物可通过加聚反应生成 | |
| D. | 该有机物属于混合物 |
8.下列事故处理方法正确的是( )
| A. | 汽油失火时,立即用水灭火 | |
| B. | 电线短路失火时,用大量的水灭火 | |
| C. | 浓NaOH 溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液 | |
| D. | 浓硫酸溅到皮肤上,立即用稀 NaOH 溶液洗涤 |
18.用NA表示阿伏伽德罗常数的值,下列有关说法中正确的是( )
| A. | 200mL 2mol/L蔗糖溶液中所含分子数为0.4NA | |
| B. | 标准状况下,2.24L HF的氢原子数目为0.1 NA | |
| C. | 黑火药爆炸的方程式为2KNO3+3C+S═K2S+N2↑+3CO2↑,当生成1molK2S时转移电子数为2NA | |
| D. | 标准状况下,1.12L 1H2和0.2g2H2均含有0.1 NA质子 |
2.下列关于“焰色反应”的相关叙述不正确的是( )
| A. | 某“焰色反应”的焰色结果为黄色,则样品中一定含“Na”元素,未必不含“K”元素 | |
| B. | 做“焰色反应”实验时,如果没有铂丝,可用铁丝代替 | |
| C. | “焰色”是金属单质或其离子燃烧时体现出来的火焰颜色 | |
| D. | 做“焰色反应“实验时,用于清洗铂丝的酸宜选用盐酸,不宜选用硫酸 |
3.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 7.8g Na2O2中离子总数为0.4NA | |
| B. | 标准状况下,11.2L CCl4的分子数为0.5NA | |
| C. | 常温常压下,48 g O2和O3的混合气体中含有的氧原子数为3NA | |
| D. | 1mol•L-1MgCl2溶液中含有氯离子个数为2NA |