题目内容
16.为了在实验室制取干燥的氨气,现提供有如图1实验仪器,请选择合适的仪器组合实验装置进行实验.(1)组合实验装置时各种仪器的正确连接顺序为(按从左到右的顺序写明仪器的编号①②…)①③④,集气装置进气口为b.
(2)写出实验室制取氨气的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(3)如何检验氨气是否已收集满(简述操作方法、现象和结论)用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,则氨气已满
..
(4)因考虑环境保护问题,某同学在集气装置后设计了尾气吸收装置,请在图2方框内画出该尾气吸收装置,并指明装置中盛放的药品.

分析 (1)实验室制取干燥的氨气,装置顺序按照发生装置、净化装置、收集装置排序,注意氨气为碱性气体,应选择碱性干燥剂碱石灰干燥;氨气密度小于空气密度,用向下排空气法收集;
(2)实验室用加热氯化铵和氢氧化钙的方法制取氨气;
(3)氨气为碱性气体,与水反应生成NH3•H2O,电离子出OH-离子,溶液呈碱性,可以利用湿润的红色石蕊试纸检验,也可以利用氨气和氯化氢气体相遇生成白烟设计实验;
(4)氨气极易溶于水可以采用水吸收,但是应注意防止倒吸的发生.
解答 解:(1)实验室制取干燥的氨气,装置顺序按照发生装置、净化装置、收集装置排序,注意氨气为碱性气体,应选择碱性干燥剂碱石灰干燥,所以正确的顺序为:①③④;
用向下排空气法收集,所以进气口为b;
故答案为:①③④;b;
(2)氯化铵与氢氧化钙在加热条件下反应生成氨气、氯化钙和水,化学方程式:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(3)氨气为碱性气体,与水反应生成NH3•H2O,电离子出OH-离子,溶液呈碱性,用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,则氨气已满,
故答案为:用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,则氨气已满;
(4)氨气极易溶于水可以采用水吸收,但是应注意防止倒吸的发生,装置图为: ;
;
故答案为: .
.
点评 本题考查了氨气的实验室制备方法、收集方法,熟悉氨气制备原理和氨气的性质是解题关键,注意氨气极易溶于水,尾气吸收应采取防止倒吸的设备.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
6.下列离子方程式属于盐类的水解,且书写正确的是( )
| A. | NaHCO3溶液:HCO3-+H2O?CO32-+H3O+ | |
| B. | NaHS溶液:HS-+H2O?H2S+OH- | |
| C. | Na2CO3溶液:CO32-+2H2O?H2CO3+2OH- | |
| D. | NH4Cl溶于D2O中:NH4++D2O?NH3•D2O+H+ |
4.下列有关钠的叙述中错误的是( )
| A. | 钠具有强还原性 | |
| B. | 金属钠可以保存在煤油中 | |
| C. | 钠的密度比水小 | |
| D. | 钠与硫酸铜溶液反应,可以置换出铜 |
11.1.68g碳粉与一定量的浓硫酸反应,生成CO2气体2.24L(标况下),则参加该反应的硫酸的物质的量为( )
| A. | 0.2mol | B. | 0.5 mol | C. | 0.56 mol | D. | 0.4 mol |
1.某有机物的结构简式如图,下列关于该有机物的叙述中不正确的是( )
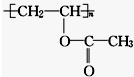

| A. | 1 mol 该有机物与 NaOH 溶液完全反应时,消耗 1 mol NaOH | |
| B. | 该有机物水解所得产物能发生酯化反应 | |
| C. | 该有机物可通过加聚反应生成 | |
| D. | 该有机物属于混合物 |
8.下列事故处理方法正确的是( )
| A. | 汽油失火时,立即用水灭火 | |
| B. | 电线短路失火时,用大量的水灭火 | |
| C. | 浓NaOH 溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液 | |
| D. | 浓硫酸溅到皮肤上,立即用稀 NaOH 溶液洗涤 |
6.下列物质中,能够导电的电解质是( )
| A. | 液态HCl | B. | 熔融的MgCl2 | C. | NaCl溶液 | D. | 蔗糖 |