题目内容
13.江苏有着丰富的海水资源,合理利用资源和保护环境是我省可持续发展的重要保证.(1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料.试写出由无水氯化镁制取金属镁的化学反应方程式MgCl2 $\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
(2)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水.排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入Na2S(选填“Na2S”或“NaOH”)效果更好.
| 难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
| Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |
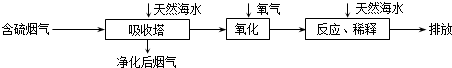
①天然海水的pH≈8海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子,试用离子方程式解释天然海水呈弱碱性的原因CO32-+H2O?HCO3-+OH-或 HCO3-+H2O?H2CO3+OH-(任写一个).
②某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如图所示.

请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议:降低含硫烟气温度(或流速).
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,通入氧气氧化的化学原理是2H2SO3+O2=4H++2SO42-或2HSO3-+O2=2H++2SO42-(任写一个化学方程式或离子方程式).氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+).
分析 (1)镁为活泼金属,可由无水氯化镁电解制取金属镁;
(2)根据题目中所给难溶电解质的Ksp,可知Cu2+和Pb2+的硫化物Ksp更小,更难溶;
(3)①强碱弱酸盐的水解呈碱性,据此书写反应的方程式;
②根据图示可知:SO2的吸收效率随着温度的升高而降低,随流速的增大而降低,
③H2SO3或HSO3-中的S显+4价,均可被O2氧化生成H++SO42-,酸性会大大增强,氧化后的“海水”需要引入大量的显碱性的海水与之混合后才能排放,主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+).
解答 解:(1)电解无水氯化镁可制取金属镁,该反应的化学反应方程式为:MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑,
故答案为:MgCl2 $\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑;
(2)根据题目中所给难溶电解质的Ksp,可知Cu2+和Pb2+的硫化物Ksp更小,更难溶;所以用Na2S除去污水中的Cu2+和Pb2+效果更好,
故答案为:Na2S;
(3)①天然海水的pH≈8,是因为海水中有CO32-或HCO3-+它们水解使海水呈弱碱性,其离子方程式为CO32-+H2O?HCO3-+OH-或 HCO3-+H2O?H2CO3+OH-,
故答案为:CO32-+H2O?HCO3-+OH-或 HCO3-+H2O?H2CO3+OH-;
②根据图示可知:SO2的吸收效率随着温度的升高而降低,随流速的增大而降低,所以要提高含硫烟气中SO2的吸收效率,可以降低含硫烟气温度(或流速),
故答案为:降低含硫烟气温度(或流速);
③H2SO3或HSO3-中的S显+4价,均可被O2氧化生成H++SO42-,酸性会大大增强,氧化后的“海水”需要引入大量的显碱性的海水与之混合后才能排放,主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+),
故答案为:2H2SO3+O2=4H++2SO42-或2HSO3-+O2=2H++2SO42-;中和、稀释经氧气氧化后海水中生成的酸(H+).
点评 本题考查了方程式的书写,氧化还原反应,沉淀溶解平衡,盐类水解等,掌握基础是关键,题目难度中等,综合性较强.

| A. | 5mol | B. | $\frac{5}{3}$mol | C. | $\frac{5}{6}$mol | D. | $\frac{2}{5}$mol |

下列说法正确的是( )
| A. | 向品红溶液中同时通入Cl2、SO2,漂白效果会更好 | |
| B. | 加热可判断品红褪色是通入SO2还是通入Cl2引起的 | |
| C. | “无色化合物”分子中,19个碳原子都可能处在同一平面上 | |
| D. | 品红分子结构中,所有原子不可能处在同一平面上 |
| A. | ①④ | B. | ②⑤ | C. | ③⑥ | D. | ④⑤ |
| A. | 能使甲基橙试液变红的溶液中:Na+、K+、MnO4-、I- | |
| B. | 含Br-、K+、Na+、HSO3-的溶液,通入SO2后这些离子仍能大量共存 | |
| C. | 含K+、Na+、NO3-、CH3COO-的溶液中c(H+)=$\sqrt{{K}_{W}}$ | |
| D. | 在水电离出的c(H+)=10-13mol•L-1 的溶液中:NH4+、AlO2-、SO42-、NO3- |
 A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )
A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )| A. | 若X为Cl2,则C可为FeCl3 | |
| B. | 若X为KOH溶液,则A可为AlCl3 | |
| C. | 若X为O2,则A可为碳 | |
| D. | 若A、B、C均为焰色反应呈黄色的化合物,则X可为CO2 |
| A. | 常温常压下,28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| B. | 室温下,1LpH=13的Ba(OH)2溶液中含有的Ba2+个数为0.1NA | |
| C. | 1molFeI2与足量氯气反应时转移的电子数为2NA | |
| D. | 78g苯含有C=C键的数目为3NA |

 X、Y、Z、W四种物质有如下相互转化关系(其中X、W为单质,Y、Z为化合物,未列出反应条件).
X、Y、Z、W四种物质有如下相互转化关系(其中X、W为单质,Y、Z为化合物,未列出反应条件). .
.