题目内容
2.设NA为阿伏伽德罗常数的值.下列说法正确的是( )| A. | 常温常压下,28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| B. | 室温下,1LpH=13的Ba(OH)2溶液中含有的Ba2+个数为0.1NA | |
| C. | 1molFeI2与足量氯气反应时转移的电子数为2NA | |
| D. | 78g苯含有C=C键的数目为3NA |
分析 A、乙烯和环丁烷的最简式均为CH2;
B、氢氧化钡溶液中,氢氧根和钡离子的个数之比为2:1;
C、FeI2中亚铁离子和碘离子均能被氯气氧化;
D、苯不是单双键交替的结构.
解答 解:A、乙烯和环丁烷的最简式均为CH2,故28g混合物中含有的CH2的物质的量为n=$\frac{28g}{14g/mol}$=2mol,故含2mol碳原子即2NA个,故A正确;
B、氢氧化钡溶液中,氢氧根和钡离子的个数之比为2:1,而1LpH=13的氢氧化钡溶液中氢氧根的物质的量n=CV=0.1mol/L×1L=0.1mol,故含钡离子0.05mol,个数为0.05NA个,故B错误;
C、FeI2中亚铁离子和碘离子均能被氯气氧化,故1molFeI2中有1mol亚铁离子和2mol碘离子被氧化,失去3mol电子即3NA个,故C错误;
D、苯不是单双键交替的结构,故苯中无碳碳双键,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
12.下列各组离子一定能大量共存的是( )
| A. | 在无色溶液中:NH4+、Fe2+、SO42-、CO32- | |
| B. | 在含大量Ba2+溶液中:NH4+、Na+、Cl-、OH- | |
| C. | 在强碱溶液中:Na+、K+、Cl-、SO32- | |
| D. | 在酸性的溶液中:K+、Fe2+、Cl-、CH3COO- |
13.江苏有着丰富的海水资源,合理利用资源和保护环境是我省可持续发展的重要保证.
(1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料.试写出由无水氯化镁制取金属镁的化学反应方程式MgCl2 $\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
(2)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水.排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入Na2S(选填“Na2S”或“NaOH”)效果更好.
(3)火力发电在江苏的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如图所示:
①天然海水的pH≈8海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子,试用离子方程式解释天然海水呈弱碱性的原因CO32-+H2O?HCO3-+OH-或 HCO3-+H2O?H2CO3+OH-(任写一个).
②某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如图所示.

请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议:降低含硫烟气温度(或流速).
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,通入氧气氧化的化学原理是2H2SO3+O2=4H++2SO42-或2HSO3-+O2=2H++2SO42-(任写一个化学方程式或离子方程式).氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+).
(1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料.试写出由无水氯化镁制取金属镁的化学反应方程式MgCl2 $\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
(2)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水.排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入Na2S(选填“Na2S”或“NaOH”)效果更好.
| 难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
| Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |

①天然海水的pH≈8海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子,试用离子方程式解释天然海水呈弱碱性的原因CO32-+H2O?HCO3-+OH-或 HCO3-+H2O?H2CO3+OH-(任写一个).
②某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如图所示.

请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议:降低含硫烟气温度(或流速).
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,通入氧气氧化的化学原理是2H2SO3+O2=4H++2SO42-或2HSO3-+O2=2H++2SO42-(任写一个化学方程式或离子方程式).氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+).
10.下列说法不正确的是( )
| A. | 热的纯碱溶液比冷的纯碱溶液去油污效果好 | |
| B. | 盛放Na2CO3溶液的试剂瓶不能用橡胶塞 | |
| C. | 将AlCl3溶液加热、蒸干、灼烧,可得到固体Al2O3 | |
| D. | 铁在潮湿的环境下生锈与盐类水解无关 |
17.表示下列变化的化学用语不正确的是( )
| A. | 氨水显碱性:NH3•H2O?NH4++OH- | |
| B. | Na2S溶液显碱性:S2-+2H2O?H2S+2OH- | |
| C. | 硫酸氢钠溶液显酸性:NaHSO4═Na++H++SO42- | |
| D. | FeCl3溶液显酸性:Fe3++3H2O?Fe(OH)3+3H+ |
7.下列实验中能达到实验目的是( )
| A. |  用装置氧化废液中的溴化氢 | B. |  量取100.00mL溶液 | ||
| C. |  将萃取液中的苯与碘进行分离 | D. |  灼烧熔融碳酸钠固体 |
14.下列有关化学用语表示正确的是( )
| A. | HCl的电子式: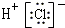 | B. | ${\;}_{8}^{18}$O2-离子的原子结构示意图: | ||
| C. | CO2分子的结构式:O=C=O | D. | 四氯化碳分子比例模型: |
11.2015年8月12日天津港危险品仓库发生的爆炸事故,再次警示人们不可忽视化学试剂的规范储存.下列叙述不正确的是( )
| A. | 钠保存在细口瓶中并加煤油液封 | |
| B. | 新制氯水保存在棕色瓶中并置于冷暗处 | |
| C. | NaOH溶液保存在无色试剂瓶中并要塞紧橡胶塞 | |
| D. | 硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中 |
12.下列有关化学药品的存放说法不正确的是( )
| A. | 液溴易挥发,实验室常用水液封并密封保存 | |
| B. | 金属钠遇到氧气立即反应,常保存在煤油中 | |
| C. | 浓硫酸有强腐蚀性,常温时不可用铁质容器贮运 | |
| D. | 硅酸钠溶液应用带橡胶塞的细口瓶保存 |