题目内容
19.下列实验操作、现象或结论正确的是( )| A. | 蒸发操作时,应使蒸发皿中的水分完全蒸干后,才能停止加热 | |
| B. | 加入盐酸,放出无色无味气体,该气体能使澄清石灰水变浑浊的气体,则原溶液中只含CO32- | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 除去铜粉中混有的少量镁粉和铝粉可加入足量氢氧化钠溶液,反应后过滤、洗涤 |
分析 A.蒸发时,当蒸发皿中出现大量固体时停止加热,避免造成固体飞溅;
B.原溶液中也可能存在HCO3-;
C.分液时应避免液体重新混合而污染;
D.铝粉能与氢氧化钠溶液反应,而镁不反应.
解答 解:A.蒸发时,不能直接蒸干,当有大量固体析出时可停止加热,用余热蒸干,防止蒸干后温度过高而导致固体分解,故A错误;
B.加入盐酸,放出无色无味气体,该气体能使澄清石灰水变浑浊的气体,该气体为二氧化碳,原溶液中可能存在HCO3-,故B错误;
C.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,可避免液体重新混合而污染,故C正确;
D.镁粉不与氢氧化钠溶液反应、但铝粉能与氢氧化钠溶液反应、反应时能把杂质除去,而且原物质也保留,故C错误;
故选C.
点评 本题考查化学实验方案的评价,题目难度不大,涉及物质的检验、分离等操作,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同以及实验方案的评价原则.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目
9.某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
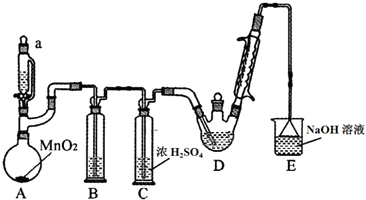
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl,可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O;CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质:
(1)仪器a的名称是恒压分液漏斗,球形冷凝管的水流方向是下口进上口出.
(2)装置B中的试剂是饱和食盐水,若撤去装置B,可能导致装置D中副产物CCl3COOH、C2H5Cl(填化学式)的量增加.
(3)写出E中所有可能发生的无机反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
(4)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH.你认为此方案是否可行及其原因不可行,三氯乙酸可溶于乙醇、三氯乙醛.
(5)测定产品纯度:称取产品0.40g配成待测溶液,加入0.1000mol•L-1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000mol/LNa2S2O3溶液滴定至终点.进行三次平行实验,测得消耗Na2S2O3溶液20.00mL.则产品的纯度为66.4%.(计算结果保留三位有效数字)
滴定的反应原理:CCl3CHO+OH-=CHCl3+HCOO-;HCOO-+I2=H++2I-+CO2↑;I2+2S2O32-═2I-+S4O62-
(6)为证明三氯乙酸的酸性比乙酸强,某学习小组的同学设计了以下三种方案,你认为能够达到实验目的是ABC
A.分别测定0.1mol/L两种酸溶液的pH,三氯乙酸的pH较小
B.用仪器测量浓度均为0.1mol/L的三氯乙酸和乙酸溶液的导电性,测得乙酸溶液的导电性弱
C.测定等物质的量浓度的两种酸的钠盐溶液的pH,乙酸钠溶液的pH较大.

①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl,可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O;CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水,乙醇 | 可溶于水,乙醇,三氯乙醛 | 微溶于水,可溶于乙醇 |
(2)装置B中的试剂是饱和食盐水,若撤去装置B,可能导致装置D中副产物CCl3COOH、C2H5Cl(填化学式)的量增加.
(3)写出E中所有可能发生的无机反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
(4)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH.你认为此方案是否可行及其原因不可行,三氯乙酸可溶于乙醇、三氯乙醛.
(5)测定产品纯度:称取产品0.40g配成待测溶液,加入0.1000mol•L-1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000mol/LNa2S2O3溶液滴定至终点.进行三次平行实验,测得消耗Na2S2O3溶液20.00mL.则产品的纯度为66.4%.(计算结果保留三位有效数字)
滴定的反应原理:CCl3CHO+OH-=CHCl3+HCOO-;HCOO-+I2=H++2I-+CO2↑;I2+2S2O32-═2I-+S4O62-
(6)为证明三氯乙酸的酸性比乙酸强,某学习小组的同学设计了以下三种方案,你认为能够达到实验目的是ABC
A.分别测定0.1mol/L两种酸溶液的pH,三氯乙酸的pH较小
B.用仪器测量浓度均为0.1mol/L的三氯乙酸和乙酸溶液的导电性,测得乙酸溶液的导电性弱
C.测定等物质的量浓度的两种酸的钠盐溶液的pH,乙酸钠溶液的pH较大.
10.在某些火箭发射中常用肼(N2H4)为燃料.0.1mol N2H4(气态)在O2(气态)中燃烧生成N2(气态)和H2O(气态),放出53.4kJ的热量,则下列热化学方程式正确的是( )
| A. | N2H4(g)+2O2(g)═N2(g)+2H2O(g);△H=+534 kJ•L-1 | |
| B. | N2H4(g)+2O2(g)═N2(g)+2H2O(g);△H=-53.4 kJ•L-1 | |
| C. | N2H4(g)+2O2(g)═N2(g)+2H2O(g);△H=+53.4 kJ•L-1 | |
| D. | N2H4(g)+2O2(g)═N2(g)+2H2O(g);△H=-534 kJ•L-1 |
4.下列离子能大量共存且溶液为无色透明的是( )
| A. | Na+、OH-、NO3-、HCO3- | B. | Na+、Fe3+、Cl-、SCN- | ||
| C. | Na+、Al3+、NO3-、Cl- | D. | K+、Cu2+、SO42-、OH- |
8.下列对于苯的化学性质的叙述中正确的是( )
| A. | 苯与溴水发生加成反应而使溴水褪色 | |
| B. | 苯与溴水发生取代反应而使溴水褪色 | |
| C. | 苯不能使酸性高锰酸钾溶液褪色 | |
| D. | 苯与浓硝酸、浓硫酸的混合物发生的反应不是取代反应 |

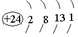 与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu(填元素符号),其中一种金属的晶胞结构如图1所示,该晶胞中含有金属原子的数目为4.
与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu(填元素符号),其中一种金属的晶胞结构如图1所示,该晶胞中含有金属原子的数目为4.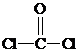 ,其中碳氧原子之间共价键是c(填序号)
,其中碳氧原子之间共价键是c(填序号)
 如图是实验室制乙酸乙酯的装置.
如图是实验室制乙酸乙酯的装置.