题目内容
9.某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下: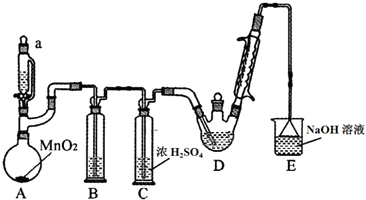
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl,可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O;CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水,乙醇 | 可溶于水,乙醇,三氯乙醛 | 微溶于水,可溶于乙醇 |
(2)装置B中的试剂是饱和食盐水,若撤去装置B,可能导致装置D中副产物CCl3COOH、C2H5Cl(填化学式)的量增加.
(3)写出E中所有可能发生的无机反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
(4)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH.你认为此方案是否可行及其原因不可行,三氯乙酸可溶于乙醇、三氯乙醛.
(5)测定产品纯度:称取产品0.40g配成待测溶液,加入0.1000mol•L-1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000mol/LNa2S2O3溶液滴定至终点.进行三次平行实验,测得消耗Na2S2O3溶液20.00mL.则产品的纯度为66.4%.(计算结果保留三位有效数字)
滴定的反应原理:CCl3CHO+OH-=CHCl3+HCOO-;HCOO-+I2=H++2I-+CO2↑;I2+2S2O32-═2I-+S4O62-
(6)为证明三氯乙酸的酸性比乙酸强,某学习小组的同学设计了以下三种方案,你认为能够达到实验目的是ABC
A.分别测定0.1mol/L两种酸溶液的pH,三氯乙酸的pH较小
B.用仪器测量浓度均为0.1mol/L的三氯乙酸和乙酸溶液的导电性,测得乙酸溶液的导电性弱
C.测定等物质的量浓度的两种酸的钠盐溶液的pH,乙酸钠溶液的pH较大.
分析 A装置利用二氧化锰与浓盐酸制备氯气,反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,B装置用饱和食盐水除去HCl,C装置盛放浓硫酸干燥氯气,D中反应制备CCl3CHO,E装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl防止污染空气.
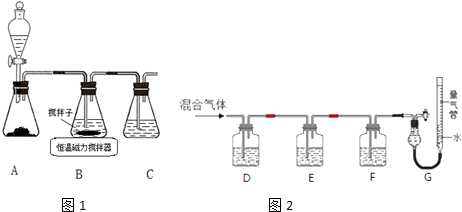
(1)由仪器的结构,可知仪器a为恒压分液漏斗;冷凝管水流遵循逆流原理,这样冷凝更充分,效果更好;
(2)浓盐酸易挥发,制得的氯气中含有氯化氢,用饱和食盐水除去HCl;撤去B装置,增大副反应C2H5OH+HCl→C2H5Cl+H2O的发生;
(3)有机物易挥发性,冷凝回流挥发的有机物;E装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl,氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠与水,HCl与氢氧化钠反应生成氯化钠与水;
(4)根据CCl3COOH溶于乙醇与CCl3CHO分析;
(5)根据消耗的Na2S2O3计算剩余I2的物质的量,进而计算与HCOO-反应的I2的物质的量,再根据关系式:CCl3CHO~HCOO-~I2计算;
(6)A.酸性越强,电离程度越大,溶液pH越小;
B.电离程度越大,酸性越强,溶液中离子浓度越大,导电能力越强;
C.酸性越弱,其钠盐的水解程度越大,溶液pH越大.
解答 解:(1)由仪器a的结构可知,该分液漏斗能平衡压强,使漏斗内液体顺利滴下,为恒压分液漏斗,冷凝管水流遵循逆流原理,水流方向是下口进上口出,
故答案为:恒压分液漏斗;下口进上口出;
(2)浓盐酸制取的氯气中含有氯化氢和水蒸气杂质,应用饱和的食盐水除掉氯化氢,当含氯化氢的氯气通过饱和食盐水时,氯化氢溶解在其中,氯气几乎不溶,氯气能与水反应生成HCl与HClO,会发生:CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl、C2H5OH+HCl→C2H5Cl+H2O,导致装置D中副产物:CCl3COOH、C2H5Cl增多,
故答案为:饱和食盐水;CCl3COOH、C2H5Cl;
(3)E装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl防止污染空气,反应离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O; H++OH-=H2O;
(4)CCl3COOH溶于乙醇与CCl3CHO,应采取蒸馏方法进行分离,
故答案为:不可行,三氯乙酸可溶于乙醇、三氯乙醛;
(5)根据消耗的Na2S2O3计算
剩余I2的物质的量0.02000mol•L-1×0.02L×$\frac{1}{2}$=2×10-4mol,与HCOO-反应的I2的物质的量为0.1000mol•L-1×0.02L-2×10-4mol=1.8×10-3mol,由CCl3CHO~HCOO-~I2可知,CCl3CHO的物质的量为1.8×10-3mol,则产品的纯度为$\frac{1.8×1{0}^{-3}mol×147.5g/mol}{0.4g}$×100%=66.4%,
故答案为:66.4%;
(6)A.分别测定0.1mol•L-1两种酸溶液的pH,三氯乙酸的pH较小,说明三氯乙酸电离程度比乙酸的大,则三氯乙酸的酸性比乙酸的强,故A正确;
B.用仪器测量浓度均为0.1mol•L-1的三氯乙酸和乙酸溶液的导电性,测得乙酸溶液的导电性弱,三氯乙酸溶液中离子浓度更大,说明三氯乙酸电离程度比乙酸的大,则三氯乙酸的酸性比乙酸的强,故B正确;
C.测定等物质的量浓度的两种酸的钠盐溶液的pH,乙酸钠溶液的pH较大,说明乙酸钠的水解程度更大,则乙酸的酸性比三氯乙酸的弱,故C正确;
故答案为:ABC.
点评 本题考查三氯乙醛的制备,关键是明确反应原理与各装置作用,掌握常用物质分离提纯方法,注意对题目信息的应用,题目难度中等.

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案| A. | 溶有1molFe(OH)3的胶体中,含有NA个Fe(OH)3胶粒 | |
| B. | 在标准状况下,22.4L水的分子数为NA | |
| C. | 常温常压下,14 gC2H4和 C3H6 的混合物含有的氢原子数为2NA | |
| D. | 1molFe与足量Cl2反应,铁失去电子数为2NA |
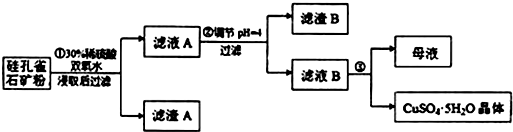
请回答下列问题:
(1)完成步骤①中稀硫酸与CuSiO3•2H2O发生反应的化学方程式
CuSiO3•2H2O+H2SO4═CuSO4+H4SiO4+H2O;
用离子方程式表示双氧水的作用2Fe2++H2O2+2H+═2Fe3++2H2O.
(2)步骤②调节溶液pH选用的最佳试剂是B
A.Fe2O3 B.CuO C.Al2O3 D.NH3•H2O
(3)有关氢氧化物开始沉淀和完全沉淀的pH如表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 完全沉淀的pH | 5.2 | 3.7 | 9.7 | 6.7 |
(4)滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到CuSO4•5H2O晶体.某同学认为上述操作会拌有硫酸铝晶体的析出.请你结合相关数据对该同学的观点予以评价(已知常温下,Al2(SO4)3饱和溶液中c(Al3+)=2.25mol•L-1,Ksp[Al(OH)3]=3.2×10-34)该同学的观点是错误的;通过计算可知,滤液B中,c(Al3+)=3.2×10-4mol/L,浓缩后c(Al3+)=6.4×10-4mol/L<<2.25mol/L,所以不会有硫酸铝晶体析出.
| A. | 铁在潮湿空气中生锈是自发过程 | B. | 有些放热反应常温下是非自发的 | ||
| C. | 自发反应都是熵增大的反应 | D. | 电解池的反应不都是非自发反应 |
| A. | 蒸发操作时,应使蒸发皿中的水分完全蒸干后,才能停止加热 | |
| B. | 加入盐酸,放出无色无味气体,该气体能使澄清石灰水变浑浊的气体,则原溶液中只含CO32- | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 除去铜粉中混有的少量镁粉和铝粉可加入足量氢氧化钠溶液,反应后过滤、洗涤 |