题目内容
10.在某些火箭发射中常用肼(N2H4)为燃料.0.1mol N2H4(气态)在O2(气态)中燃烧生成N2(气态)和H2O(气态),放出53.4kJ的热量,则下列热化学方程式正确的是( )| A. | N2H4(g)+2O2(g)═N2(g)+2H2O(g);△H=+534 kJ•L-1 | |
| B. | N2H4(g)+2O2(g)═N2(g)+2H2O(g);△H=-53.4 kJ•L-1 | |
| C. | N2H4(g)+2O2(g)═N2(g)+2H2O(g);△H=+53.4 kJ•L-1 | |
| D. | N2H4(g)+2O2(g)═N2(g)+2H2O(g);△H=-534 kJ•L-1 |
分析 先计算出1molN2H4(气态)完全反应生成N2(气态)和H2O(气态)放出的热量,然后写出该反应的热化学方程式即可.
解答 解:0.1mol N2H4(气态)在O2(气态)中燃烧生成N2(气态)和H2O(气态),
则1mol N2H4(气态)完全反应生成N2(气态)和H2O(气态)放出的热量为:53.4kJ×$\frac{1mol}{0.1mol}$=534kJ,
所以该反应的热化学方程式为:N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534 kJ•mol-1,
故选D.
点评 本题考查了热化学方程式书写、盖斯定律的应用,题目难度中等,明确盖斯定律的内容为解答关键,注意掌握热化学方程式的概念及书写原则,试题培养了学生的灵活应用能力.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
1.硅孔雀石是一种含铜的矿石,含铜形态为CuCO3•Cu(OH)2和CuSiO3•2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质.以硅孔雀石为原料制取硫酸铜的工艺流程如图:
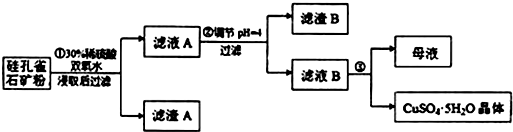
请回答下列问题:
(1)完成步骤①中稀硫酸与CuSiO3•2H2O发生反应的化学方程式
CuSiO3•2H2O+H2SO4═CuSO4+H4SiO4+H2O;
用离子方程式表示双氧水的作用2Fe2++H2O2+2H+═2Fe3++2H2O.
(2)步骤②调节溶液pH选用的最佳试剂是B
A.Fe2O3 B.CuO C.Al2O3 D.NH3•H2O
(3)有关氢氧化物开始沉淀和完全沉淀的pH如表:
由上表可知:当溶液pH=4时,可以完全除去的离子是Fe3+,不能完全除去的离子是Al3+.
(4)滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到CuSO4•5H2O晶体.某同学认为上述操作会拌有硫酸铝晶体的析出.请你结合相关数据对该同学的观点予以评价(已知常温下,Al2(SO4)3饱和溶液中c(Al3+)=2.25mol•L-1,Ksp[Al(OH)3]=3.2×10-34)该同学的观点是错误的;通过计算可知,滤液B中,c(Al3+)=3.2×10-4mol/L,浓缩后c(Al3+)=6.4×10-4mol/L<<2.25mol/L,所以不会有硫酸铝晶体析出.

请回答下列问题:
(1)完成步骤①中稀硫酸与CuSiO3•2H2O发生反应的化学方程式
CuSiO3•2H2O+H2SO4═CuSO4+H4SiO4+H2O;
用离子方程式表示双氧水的作用2Fe2++H2O2+2H+═2Fe3++2H2O.
(2)步骤②调节溶液pH选用的最佳试剂是B
A.Fe2O3 B.CuO C.Al2O3 D.NH3•H2O
(3)有关氢氧化物开始沉淀和完全沉淀的pH如表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 完全沉淀的pH | 5.2 | 3.7 | 9.7 | 6.7 |
(4)滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到CuSO4•5H2O晶体.某同学认为上述操作会拌有硫酸铝晶体的析出.请你结合相关数据对该同学的观点予以评价(已知常温下,Al2(SO4)3饱和溶液中c(Al3+)=2.25mol•L-1,Ksp[Al(OH)3]=3.2×10-34)该同学的观点是错误的;通过计算可知,滤液B中,c(Al3+)=3.2×10-4mol/L,浓缩后c(Al3+)=6.4×10-4mol/L<<2.25mol/L,所以不会有硫酸铝晶体析出.
18.下列说法不正确的是( )
| A. | 铁在潮湿空气中生锈是自发过程 | B. | 有些放热反应常温下是非自发的 | ||
| C. | 自发反应都是熵增大的反应 | D. | 电解池的反应不都是非自发反应 |
5.N2O4(无色)?2NO2(红综色),其能量变化示意图如下,则关于该反应的说法正确的是( )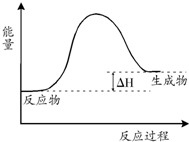

| A. | 该反应是吸热反应 | |
| B. | 当反应达到平衡时,升高温度,混合气体的颜色变浅 | |
| C. | 反应体系中加入催化剂对反应热是有影响 | |
| D. | 在反应体系中加入催化剂,正反应速率增大,逆反应速率减小 |
15.实验室用密度1.18g/mL、质量分数为36.5%的浓盐酸配制500mL 0.1mol/L 的盐酸,回答下列问题:
(1)配制500mL 0.1mol/L 的盐酸
(2)配制时,正确的操作顺序是B C A F E D (填编号).
A用适量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶,振荡
B 用量筒准确量取所需的浓盐酸,沿玻璃棒倒入烧杯中,再加入适量蒸馏水,用玻璃棒搅拌,使其混合均匀
C 将已冷却的溶液沿玻璃棒注入所选容量瓶中
D 盖好瓶塞,上下颠倒摇匀
E 改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F 继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
(3)操作A中,将洗涤液都注入容量瓶,其目的是保证溶质全部转入容量瓶中,若无操作A,则所配溶液浓度偏小(填“偏大”、“偏小”或“不变”)
(4)E中加蒸馏水不慎超过了刻度线,则所配溶液浓度偏小(填“偏大”、“偏小”或“不变”),应如何处理重新配制.
(1)配制500mL 0.1mol/L 的盐酸
| 应量取的浓盐酸的体积/mL | 应选用的容量瓶的规格/mL | 除容量瓶外需要的其他仪器 |
A用适量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶,振荡
B 用量筒准确量取所需的浓盐酸,沿玻璃棒倒入烧杯中,再加入适量蒸馏水,用玻璃棒搅拌,使其混合均匀
C 将已冷却的溶液沿玻璃棒注入所选容量瓶中
D 盖好瓶塞,上下颠倒摇匀
E 改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F 继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
(3)操作A中,将洗涤液都注入容量瓶,其目的是保证溶质全部转入容量瓶中,若无操作A,则所配溶液浓度偏小(填“偏大”、“偏小”或“不变”)
(4)E中加蒸馏水不慎超过了刻度线,则所配溶液浓度偏小(填“偏大”、“偏小”或“不变”),应如何处理重新配制.
2.实验室里需要配制480mL0.1mol/L的硫酸铜溶液,下列实验用品及实验操作都正确的是( )
| 选项 | 容量瓶的容积 | 固体质量 | 实验操作 |
| A | 480mL | 硫酸铜:7.7g | 加入500mL水 |
| B | 480mL | 胆矾:12.0g | 配成500mL溶液 |
| C | 500mL | 硫酸铜:8.0g | 加入500mL水 |
| D | 500mL | 胆矾:12.5g | 配成500mL溶液 |
| A. | A | B. | B | C. | C | D. | D |
19.下列实验操作、现象或结论正确的是( )
| A. | 蒸发操作时,应使蒸发皿中的水分完全蒸干后,才能停止加热 | |
| B. | 加入盐酸,放出无色无味气体,该气体能使澄清石灰水变浑浊的气体,则原溶液中只含CO32- | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 除去铜粉中混有的少量镁粉和铝粉可加入足量氢氧化钠溶液,反应后过滤、洗涤 |
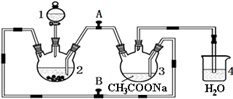 醋酸亚铬水合物[Cr(CH3COO)2]2•2H2O(相对分子质量为376)是一种深红色晶体.不溶于冷水,微溶于乙醇,不溶于乙醚(易挥发的有机溶剂)是常用的氧气吸收剂.实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒.已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:
醋酸亚铬水合物[Cr(CH3COO)2]2•2H2O(相对分子质量为376)是一种深红色晶体.不溶于冷水,微溶于乙醇,不溶于乙醚(易挥发的有机溶剂)是常用的氧气吸收剂.实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒.已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下: