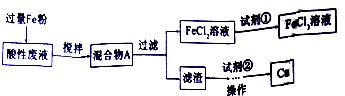
题目内容
向100ml 2mol/L的AlCl3溶液中加入未知浓度的NaOH溶液100ml,产生7.8g沉淀.则此NaOH溶液的物质的量浓度可能是( )
| A、2mol/L |
| B、1.5mol/L |
| C、3mol/L |
| D、7mol/L |
考点:镁、铝的重要化合物,化学方程式的有关计算
专题:几种重要的金属及其化合物
分析:AlCl3溶液中加入NaOH溶液,若碱不足,只发生反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl;
若碱与铝离子的物质的量之比大于3:1时,先发生反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl,后发生反应:Al(OH)3+NaOH=NaAlO2+2H2O,据此讨论计算.
若碱与铝离子的物质的量之比大于3:1时,先发生反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl,后发生反应:Al(OH)3+NaOH=NaAlO2+2H2O,据此讨论计算.
解答:
解:100ml2mol/L的AlCl3溶液中,n(Al3+)=0.1L×2mol/L=0.2mol,生成沉淀的质量是7.8g,其物质的量为
=0.1mol,可能是0.2molAl3+生成0.1mol沉淀,或者0.2molAl3+生成0.2molAl(OH)3沉淀后又溶解了0.1mol;
①若碱不足,即0.2molAl3+生成0.1mol沉淀,
AlCl3+3NaOH=Al(OH)3↓+3NaCl
0.3mol 0.1mol
NaOH的物质的量为0.1mol×3=0.3mol,c(NaOH)=
=
=3mol/L;
②碱与铝离子的物质的量之比大于3:1,小于4:1,即0.2molAl3+生成0.1mol沉淀,或者0.2molAl3+生成0.2molAl(OH)3沉淀后又溶解了0.1mol;
AlCl3 +3NaOH=Al(OH)3↓+3NaCl
0.2mol 0.6mol 0.2mol
Al(OH)3 +NaOH=NaAlO2+2H2O,
(0.2-0.1)mol 0.1mol
则消耗的碱的物质的量为0.6mol+0.1mol=0.7mol,
c(NaOH)=
=
=7mol/L;
故选:CD.
| 7.8g |
| 78g/mol |
①若碱不足,即0.2molAl3+生成0.1mol沉淀,
AlCl3+3NaOH=Al(OH)3↓+3NaCl
0.3mol 0.1mol
NaOH的物质的量为0.1mol×3=0.3mol,c(NaOH)=
| n(NaOH) |
| v |
| 0.3mol |
| 0.1L |
②碱与铝离子的物质的量之比大于3:1,小于4:1,即0.2molAl3+生成0.1mol沉淀,或者0.2molAl3+生成0.2molAl(OH)3沉淀后又溶解了0.1mol;
AlCl3 +3NaOH=Al(OH)3↓+3NaCl
0.2mol 0.6mol 0.2mol
Al(OH)3 +NaOH=NaAlO2+2H2O,
(0.2-0.1)mol 0.1mol
则消耗的碱的物质的量为0.6mol+0.1mol=0.7mol,
c(NaOH)=
| n(NaOH) |
| v |
| 0.7mol |
| 0.1v |
故选:CD.
点评:本题考查铝离子与碱的反应,明确碱的量对反应的影响及发生的化学反应是解答本题的关键,难度不大,但容易漏掉一个答案.

练习册系列答案
相关题目
化学键的键能是指气态原子间形成1mol 化学键时释放的能量.如H(g)+Cl(g)═H-Cl(g)△H=-431kJ?mol-1,即H-Cl键的键能为431kJ?mol-1,也可以理解为破坏1mol H-Cl键需要吸收431kJ的能量.已知2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol,蒸发1mol H2O(l)需要吸收的能量为44kJ,其他相关数据如下表:则表中a为( )
| H-H | O═O | H-O | |
| 键能(kJ/mol) | 436.4 | a | 462.8 |
| A、185.2 |
| B、224.0 |
| C、518.8 |
| D、494.8 |
既能与盐酸反应,又能与氢氧化钠反应的有机物是( )
| A、CH3COOH |
| B、丙氨酸 |
| C、Al(OH)3 |
| D、NaHCO3 |
鼠尾草酚可用于防治骨质疏松,鼠尾草酸可两步转化得到鼠尾草酚,下列说法正确的是( )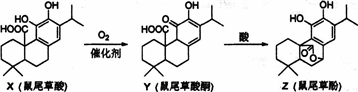

| A、X、Y、Z互为同系物 |
| B、X、Y、Z均能与FeCl3溶液发生显色反应 |
| C、1molZ与NaOH溶液反应最多消耗3molNaOH |
| D、1molY与浓溴水反应最多消耗3molBr2 |
短周期元素X、Y、Z、W、Q在元素周期表中的位置如图所示,其中X元素的最外层电子数与其电子层数相同,则下列说法正确的是( )
| Y | Z | W | ||
| X | Q |
| A、元素Y、Z、W、Q均可与氢元素形成一种或多种氢化物,其中YH4中 H的质量分数最大 |
| B、由元素X与元素W组成的物质既能溶于足量的稀盐酸,又能溶于足量的氨水 |
| C、元素Y、Z、W的单质晶体一定是同种类型的晶体 |
| D、为了增强Q单质水溶液的漂白性,可将与W同主族且相邻的元素的低价氧化物通入其中 |
煤化工的产品很多,如合成气(CO、H2)、甲醇等对煤炭工业转型具有重要意义.下列说法不正确的是( )
| A、煤转化为气态燃料,可以降低碳的排放 |
| B、甲醇的沸点是64.5℃,甲醇中的水分可采用蒸馏法分离 |
| C、工业上利用饱和的K2CO3溶液分离回收废气中的CO2,符合低碳经济理念 |
| D、采用内衬聚四氟乙烯的钢管输送合成气,可有效减缓钢管的腐蚀 |
常温时,下列说法正确的是( )
| A、新制氯水中加入固体氢氧化钠后,溶液中有c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | ||
B、加水稀释0.2 mol?L-1的醋酸溶液后,溶液中
| ||
| C、pH=3的弱酸HR溶液与pH=13的NaOH溶液等体积混合后,恰好完全反应,反应后的溶液中一定有:c(R-)+c(HR)=0.05mol?L-1 | ||
| D、0.2 mol?L-1的CH3COOH溶液与0.1 mol?L-1NaOH溶液等体积混合后溶液呈酸性,则c(CH3COO-)>c(CH3COOH)>c(Na+)>c(H+)>c(OH-) |
设NA为阿佛加德罗常数,下列叙述中正确的是( )
| A、100mL 3mol/L盐酸与5.6g Fe充分反应转移0.3NA个电子 |
| B、标准状况下,22.4L乙醇中含有的碳原子数目为2NA个 |
| C、16g O2和O3的混合物中含有的氧原子数目为NA个 |
| D、0.05mol熔融的CaCl2中含有0.1NA个阳离子 |