题目内容
某工业酸性废液中含有大量的Cu2+、Fe2+、Fe3+、Cl-等离子,变废为宝,从废液中回收铜并将铁的化合物全部转化为FeCl3溶液再利用.其流程如下:
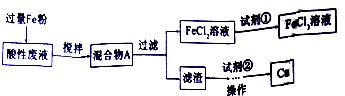
请回答下列有关问题:
(1)试剂①最好选用 .
a、Na2O2 b、Cl2 c、HNO3 d、KMnO4
(2)在该酸性废液中加入过量铁粉先后发生 个化学反应,请写出第二阶段反应的离子方程式 .
(3)简述检验混合物A中是否含有Fe3+ .
(4)加入试剂②至得到纯铜所需要的基本操作有 .

请回答下列有关问题:
(1)试剂①最好选用
a、Na2O2 b、Cl2 c、HNO3 d、KMnO4
(2)在该酸性废液中加入过量铁粉先后发生
(3)简述检验混合物A中是否含有Fe3+
(4)加入试剂②至得到纯铜所需要的基本操作有
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:从废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用,则废液中加过量Fe粉,混合物A为FeCl2、Fe和Cu等混合物,过滤滤渣为Fe和Cu,滤渣中加过量盐酸,因Cu与盐酸不反应,则滤液为FeCl2,将滤液中通入氯气可反应得到FeCl3溶液,然后结合实验过程及化学用语来解答.
解答:
解:从废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用,则废液中加过量Fe粉,混合物A为FeCl2、Fe和Cu等混合物,过滤滤渣为Fe和Cu,滤渣中加过量盐酸,因Cu与盐酸不反应,则滤液为FeCl2,将滤液中通入氯气可反应得到FeCl3溶液,
(1)加入试剂①,可氧化FeCl2得到FeCl3,为避免引入新杂质,可通入氯气,故答案为:b;
(2)酸性废液中含有大量的Cu2+、Fe2+、Fe3+、Cl-等离子,加入过量Fe粉,因氧化性:Fe3+>Cu2+>H+,
可分别以此发生:2Fe3++Fe=3Fe2+、Cu2++Fe=Fe2++Cu、2H++Fe=Fe2++H2↑等,第二阶段反应的离子方程式为Cu2++Fe=Fe2++Cu,
故答案为:3;Cu2++Fe=Fe2++Cu;
(3)一般离子KSCN溶液来检验铁离子,实验操作为取少量混合物A于试管中,滴加几滴KSCN溶液,溶液不变红色,则证明原溶液中不含有Fe3+,
故答案为:取少量混合物A于试管中,滴加几滴KSCN溶液,溶液不变红色,证明无Fe3+;
(4)试剂②为盐酸,可与铁反应,反应后过滤、洗涤、干燥,可得到铜,故答案为:溶解、过滤、洗涤、干燥.
(1)加入试剂①,可氧化FeCl2得到FeCl3,为避免引入新杂质,可通入氯气,故答案为:b;
(2)酸性废液中含有大量的Cu2+、Fe2+、Fe3+、Cl-等离子,加入过量Fe粉,因氧化性:Fe3+>Cu2+>H+,
可分别以此发生:2Fe3++Fe=3Fe2+、Cu2++Fe=Fe2++Cu、2H++Fe=Fe2++H2↑等,第二阶段反应的离子方程式为Cu2++Fe=Fe2++Cu,
故答案为:3;Cu2++Fe=Fe2++Cu;
(3)一般离子KSCN溶液来检验铁离子,实验操作为取少量混合物A于试管中,滴加几滴KSCN溶液,溶液不变红色,则证明原溶液中不含有Fe3+,
故答案为:取少量混合物A于试管中,滴加几滴KSCN溶液,溶液不变红色,证明无Fe3+;
(4)试剂②为盐酸,可与铁反应,反应后过滤、洗涤、干燥,可得到铜,故答案为:溶解、过滤、洗涤、干燥.
点评:本题以实验的形式考查混合物的分离、提纯,注意发生的化学反应及元素守恒的角度来分析是解答本题的关键,(3)为学生解答的易错点和难点,题目难度中等.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
向100ml 2mol/L的AlCl3溶液中加入未知浓度的NaOH溶液100ml,产生7.8g沉淀.则此NaOH溶液的物质的量浓度可能是( )
| A、2mol/L |
| B、1.5mol/L |
| C、3mol/L |
| D、7mol/L |
分离氯化钠与氯化铵的混合物,采用以下哪种方法( )
| A、加水溶解法 | B、萃取法 |
| C、分液法 | D、加热法 |
常温时0.1mol?L-1 HA溶液的pH>1,0.1mol?L-1 BOH溶液中c(OH-):c(H+)=1012,将两溶液等体积混合,以下判断正确的是( )
| A、c(OH-)<c(H+)<c(B+)<c(A-) |
| B、c(OH-)=c(H+)+c(HA) |
| C、c(H+)+c(B+)<c(A-)+c(OH-) |
| D、c(A-)=c(B+)>c(H+)=c(OH-) |
