题目内容
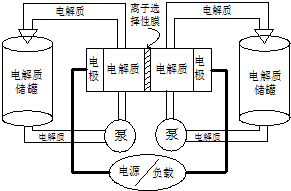 如图是一种正在投入生产的大型蓄电系统.左右两侧为电解质储罐,中央为电池,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;放电前,被膜隔开的电解质为Na2S2(右罐)和NaBr3(左罐),放电后,分别变为Na2S4和NaBr.下列说法正确的是( )
如图是一种正在投入生产的大型蓄电系统.左右两侧为电解质储罐,中央为电池,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;放电前,被膜隔开的电解质为Na2S2(右罐)和NaBr3(左罐),放电后,分别变为Na2S4和NaBr.下列说法正确的是( )| A、电池充电时,阳极电极反应式为:3Br--2e-=Br3- |
| B、电池放电时,负极电极反应式为:2S22-+2e-═S42- |
| C、电池放电时,电池的总反应方程式为:Na2S4+3NaBr=2Na2S2+NaBr3 |
| D、在充电过程中Na+通过膜的流向为从右到左 |
考点:原电池和电解池的工作原理
专题:
分析:放电前,被膜隔开的电解质为Na2S2(右罐)和NaBr3(左罐),则Na2S2在负极失电子,NaBr3在正极得电子;充电时,阴极为负极的逆反应,阳极为正极的逆反应;
A.充电时,阳极上Br-失电子转化为Br3-;
B.放电时,负极Na2S2失电子;
C.电池放电时,Na2S2和NaBr3反应;
D.充电时,阳离子向阴极移动.
A.充电时,阳极上Br-失电子转化为Br3-;
B.放电时,负极Na2S2失电子;
C.电池放电时,Na2S2和NaBr3反应;
D.充电时,阳离子向阴极移动.
解答:
解:放电前,被膜隔开的电解质为Na2S2(右罐)和NaBr3(左罐),则Na2S2在负极失电子,NaBr3在正极得电子;充电时,阴极为负极的逆反应,阳极为正极的逆反应;
A.充电时,阳极上Br-失电子转化为Br3-,则阳极的电极反应式为:3Br--2e-=Br3-,故A正确;
B.放电时,负极Na2S2失电子,则负极的电极反应式为:2S22--2e-═S42-,故B错误;
C.电池放电时,Na2S2和NaBr3反应,则电池的总反应方程式为:2Na2S2+NaBr3=Na2S4+3NaBr,故C错误;
D.放电时Na2S2为负极,充电时为阴极,Na+通过膜的流向阴极,即流向Na2S2,所以从左向右移动,故D错误.
故选A.
A.充电时,阳极上Br-失电子转化为Br3-,则阳极的电极反应式为:3Br--2e-=Br3-,故A正确;
B.放电时,负极Na2S2失电子,则负极的电极反应式为:2S22--2e-═S42-,故B错误;
C.电池放电时,Na2S2和NaBr3反应,则电池的总反应方程式为:2Na2S2+NaBr3=Na2S4+3NaBr,故C错误;
D.放电时Na2S2为负极,充电时为阴极,Na+通过膜的流向阴极,即流向Na2S2,所以从左向右移动,故D错误.
故选A.
点评:本题考查了原电池和电解池原理,题目难度较大,根据反应物中得失电子判断正负极是解题的关键.

练习册系列答案
相关题目
对于反应A+B=C,下列条件的改变一定使化学反应速率加快的是( )
| A、升高体系的温度 |
| B、增加体系的压强 |
| C、减少C的物质的量 |
| D、增加A的物质的量 |
下列根据反应原理设计的应用,不正确的是( )
| A、CO32-+H2O?HCO3-+OH-;用热的纯碱溶液清洗油污 |
| B、Al3++3H2O?Al(OH)3(胶体)+3H+;明矾净水 |
| C、TiCl4+(x+2)H2O(过量)?TiO2?xH2O↓+4HCl;制备TiO2纳米粉 |
| D、SnCl2+H2O?Sn(OH)Cl↓+HCl;配制氯化亚锡溶液时加入氢氧化钠 |
利用如图装置可实现在铜片上镀镍,下列有关说法不正确的是( )


| A、甲池是燃料电池、乙池是电镀池 |
| B、b为负极,d极为铜片 |
| C、b极上发生的电极反应为:CH4+10OH--8e-=CO32-+7H2O |
| D、c极上发生的电极反应为:Ni-2e-=Ni2+ |
下列反应中属于氧化还原反应的是( )
①2KMnO4
K2MnO4+MnO2+O2↑
②H2SO4+BaCl2═BaSO4↓+2HCl
③Zn+2HCl═ZnCl2+H2↑
④Cu2(OH)2CO3
2CuO+CO2↑+H2O.
①2KMnO4
| ||
②H2SO4+BaCl2═BaSO4↓+2HCl
③Zn+2HCl═ZnCl2+H2↑
④Cu2(OH)2CO3
| ||
| A、①② | B、②④ | C、①③ | D、③④ |
对Fe(OH)3胶体和FeCl3溶液的比较,下列不正确的是( )
| A、可用丁达尔现象区别 |
| B、加入硫酸镁溶液前者会浑浊而后者无明显现象 |
| C、可用渗析的方法分离 |
| D、可用过滤的方法分离 |