题目内容
下列根据反应原理设计的应用,不正确的是( )
| A、CO32-+H2O?HCO3-+OH-;用热的纯碱溶液清洗油污 |
| B、Al3++3H2O?Al(OH)3(胶体)+3H+;明矾净水 |
| C、TiCl4+(x+2)H2O(过量)?TiO2?xH2O↓+4HCl;制备TiO2纳米粉 |
| D、SnCl2+H2O?Sn(OH)Cl↓+HCl;配制氯化亚锡溶液时加入氢氧化钠 |
考点:盐类水解的应用,胶体的重要性质
专题:基本概念与基本理论
分析:A.盐类水解是吸热反应,升高温度促进水解;
B.铝离子水解生成氢氧化铝胶体,胶体具有吸附性;
C.TiCl4水解生成TiO2?xH2O而制备纳米材料;
D.NaOH和HCl反应生成水而促进水解.
B.铝离子水解生成氢氧化铝胶体,胶体具有吸附性;
C.TiCl4水解生成TiO2?xH2O而制备纳米材料;
D.NaOH和HCl反应生成水而促进水解.
解答:
解:A.CO32-水解是吸热反应,升高温度促进CO32-水解,导致溶液碱性增强,碱能使油脂水解,所以用热的纯碱溶液清洗油污,故A正确;
B.铝离子水解生成氢氧化铝胶体,胶体具有吸附性,能吸附水中的悬浮物而净水,所以可以用明矾净水,故B正确;
C.纳米材料中粒子直径在1-100nm之间,TiCl4水解生成TiO2?xH2O的微粒直径在1-100nm之间,所以可以制备纳米材料,故C正确;
D.SnCl2水解生成HCl,NaOH和HCl反应生成水而促进水解,导致生成Sn(OH)Cl沉淀,为防止生成沉淀,应该加入HCl抑制水解,故D错误;
故选D.
B.铝离子水解生成氢氧化铝胶体,胶体具有吸附性,能吸附水中的悬浮物而净水,所以可以用明矾净水,故B正确;
C.纳米材料中粒子直径在1-100nm之间,TiCl4水解生成TiO2?xH2O的微粒直径在1-100nm之间,所以可以制备纳米材料,故C正确;
D.SnCl2水解生成HCl,NaOH和HCl反应生成水而促进水解,导致生成Sn(OH)Cl沉淀,为防止生成沉淀,应该加入HCl抑制水解,故D错误;
故选D.
点评:本题考查盐类水解的应用,明确物质的性质是解本题关键,知道哪些方法能促进水解、哪些方法能抑制水解,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g)△H<0.下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
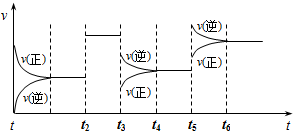

| A、t2时加入了催化剂 |
| B、t3时降低了温度 |
| C、t5时增大了压强 |
| D、该反应最初是从逆反应开始的 |
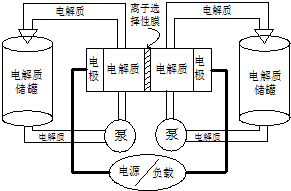 如图是一种正在投入生产的大型蓄电系统.左右两侧为电解质储罐,中央为电池,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;放电前,被膜隔开的电解质为Na2S2(右罐)和NaBr3(左罐),放电后,分别变为Na2S4和NaBr.下列说法正确的是( )
如图是一种正在投入生产的大型蓄电系统.左右两侧为电解质储罐,中央为电池,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;放电前,被膜隔开的电解质为Na2S2(右罐)和NaBr3(左罐),放电后,分别变为Na2S4和NaBr.下列说法正确的是( )| A、电池充电时,阳极电极反应式为:3Br--2e-=Br3- |
| B、电池放电时,负极电极反应式为:2S22-+2e-═S42- |
| C、电池放电时,电池的总反应方程式为:Na2S4+3NaBr=2Na2S2+NaBr3 |
| D、在充电过程中Na+通过膜的流向为从右到左 |
能源危机是制约现代社会发展的严重问题,开发和利用新能源是中国立足自身解决能源困扰的重要举措之一.背景材料:①2005国际油价飙升,新型纳米金属燃料面世;②2006年1月1日,“苏北五市”全面推广使用乙醇汽油;③到2010年,江苏省将打造成为全国最重要的太阳能产业基地;④生物柴油是以油脂为原料,通过水解、酯化所得高级脂肪酸甲酯.下列说法正确的是( )
| A、乙醇汽油的推广使用大大降低了国际市场的原油价格 |
| B、生物柴油燃烧不会产生二氧化碳,是一种清洁能源 |
| C、石油是一种清洁安全的可再生能源 |
| D、纳米金属燃料表面积大,易引发,能量释放快 |
下列说法正确的是( )
| A、硅酸胶体通常带正电 |
| B、直径为1nm---100nm的微粒是胶体 |
| C、在标准状况下,1mol苯的体积约是22.4L |
| D、在标准状况下,总质量为28g的N2和CO的混合气体,其体积约为22.4L |



