题目内容
利用如图装置可实现在铜片上镀镍,下列有关说法不正确的是( )


| A、甲池是燃料电池、乙池是电镀池 |
| B、b为负极,d极为铜片 |
| C、b极上发生的电极反应为:CH4+10OH--8e-=CO32-+7H2O |
| D、c极上发生的电极反应为:Ni-2e-=Ni2+ |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:根据电镀原理:用镍在铜片上镀镍时,镀件铜为阴极,镀层金属镍为阳极,电镀液是含有的镀层金属镍离子的盐溶液;甲是燃料电池,通入甲烷的一极为负极,通入氧气的一极为正极,据此分析.
解答:
解:A、甲装置中能发生自发的氧化还原反应,为燃料电池,乙为电镀池,故A正确;
B、甲装置为燃料电池,b极通甲烷为负极,a为正极,Cu作阴极与b相连,则c为Cu,故B错误;
C、b为燃料电池的负极,是甲烷失电子生成碳酸根离子,电极反应为:CH4+10OH--8e-═CO32-+7H2O,故C正确;
D、c极与原电池的负极相连为阴极,阴极上镍离子得电子生成镍单质,电极反应为:Ni2++2e-═Ni,故D正确;
故选B.
B、甲装置为燃料电池,b极通甲烷为负极,a为正极,Cu作阴极与b相连,则c为Cu,故B错误;
C、b为燃料电池的负极,是甲烷失电子生成碳酸根离子,电极反应为:CH4+10OH--8e-═CO32-+7H2O,故C正确;
D、c极与原电池的负极相连为阴极,阴极上镍离子得电子生成镍单质,电极反应为:Ni2++2e-═Ni,故D正确;
故选B.
点评:本题考查学生燃料电池和电镀池的工作原理方面的知识,注意把握电极方程式的书写方法,注意知识的积累是解题的关键,难度不大.

练习册系列答案
相关题目
现有Fe(OH)3和FeS的混合物28.3g与足量的稀硫酸反应后,生成1.6g单质硫,则原混合物中所含Fe(OH)3的质量可以是下列的( )
| A、10.7g |
| B、21.4g |
| C、23.9g |
| D、40.0g |
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g)△H<0.下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
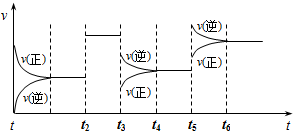

| A、t2时加入了催化剂 |
| B、t3时降低了温度 |
| C、t5时增大了压强 |
| D、该反应最初是从逆反应开始的 |
 在某一容积可变的密闭容器中,可逆反应A(g)+B(g)?xC(g)△H,符合图象(Ⅰ)所示关系.由此推断,对图象(Ⅱ)的说法不正确的是( )
在某一容积可变的密闭容器中,可逆反应A(g)+B(g)?xC(g)△H,符合图象(Ⅰ)所示关系.由此推断,对图象(Ⅱ)的说法不正确的是( )| A、p3>p4,Y轴表示A的转化率 |
| B、p3>p4,Y轴表示B的质量分数 |
| C、p3>p4,Y轴表示混合气体的密度 |
| D、p3>p4,Y轴表示混合气体的平均相对分子质量 |
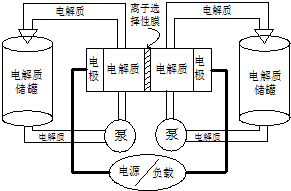 如图是一种正在投入生产的大型蓄电系统.左右两侧为电解质储罐,中央为电池,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;放电前,被膜隔开的电解质为Na2S2(右罐)和NaBr3(左罐),放电后,分别变为Na2S4和NaBr.下列说法正确的是( )
如图是一种正在投入生产的大型蓄电系统.左右两侧为电解质储罐,中央为电池,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;放电前,被膜隔开的电解质为Na2S2(右罐)和NaBr3(左罐),放电后,分别变为Na2S4和NaBr.下列说法正确的是( )| A、电池充电时,阳极电极反应式为:3Br--2e-=Br3- |
| B、电池放电时,负极电极反应式为:2S22-+2e-═S42- |
| C、电池放电时,电池的总反应方程式为:Na2S4+3NaBr=2Na2S2+NaBr3 |
| D、在充电过程中Na+通过膜的流向为从右到左 |
已知下列微粒在酸性条件下都能氧化KI(氧化产物为I2),自身发生如下变化:H2O2→H2O IO3-→I2 MnO4-→Mn2+ HNO2→NO如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
| A、H2O2 |
| B、IO3- |
| C、MnO4- |
| D、HNO2 |
下列反应中,反应前后元素的化合价没有变化的是( )
A、CO2+C
| ||||
| B、SO2+H2O=H2SO3 | ||||
| C、2NaOH+Cl2═NaCl+NaClO+H2O | ||||
D、2CO+O2
|
下列说法正确是( )
| A、摩尔是物质的质量单位 |
| B、氧气的摩尔质量是32g |
| C、0.5mol氮气的体积为11.2L |
| D、1mol硫酸根的质量为96g |