题目内容
向淀粉溶液和碘水的蓝色混合溶液中通氯气,溶液褪为无色,该反应体系有反应物和生成物共五种物质:I2、HIO3、H2O、Cl2、HCl.
(1)该反应中发生氧化反应的物质是 ,氧化剂是 ,
(2)写出该反应的化学方程式,并用双线桥标出电子转移的方向和数目 ,
(3)如反应转移了0.3mol电子,则至少需要氯气体积(标准状况下)为 .
(1)该反应中发生氧化反应的物质是
(2)写出该反应的化学方程式,并用双线桥标出电子转移的方向和数目
(3)如反应转移了0.3mol电子,则至少需要氯气体积(标准状况下)为
考点:氧化还原反应
专题:氧化还原反应专题
分析:氯气具有强氧化性,可氧化I2生成HIO3,反应的方程式为I2+5Cl2+6H2O=2HIO3+10HCl,反应中Cl元素化合价降低,I元素化合价升高,以此解答该题.
解答:
解:(1)氯气具有强氧化性,可氧化I2生成HIO3,反应的方程式为I2+5Cl2+6H2O=2HIO3+10HCl,反应中Cl元素化合价降低,Cl2为氧化剂,I元素化合价升高,被氧化,
故答案为:I2; Cl2;
(2)反应中Cl元素化合价由0价降低到-1价,I元素化合价由0价升高到+5价,转移电子数目为10,可表示为 ,
,
故答案为: ;
;
(3)由方程式可知,反应5mol氯气,转移10mol电子,则转移了0.3mol电子,消耗0.15mol氯气,体积为0.15mol×22.4L/mol=3.36L,故答案为:3.36 L.
故答案为:I2; Cl2;
(2)反应中Cl元素化合价由0价降低到-1价,I元素化合价由0价升高到+5价,转移电子数目为10,可表示为
 ,
,故答案为:
 ;
;(3)由方程式可知,反应5mol氯气,转移10mol电子,则转移了0.3mol电子,消耗0.15mol氯气,体积为0.15mol×22.4L/mol=3.36L,故答案为:3.36 L.
点评:本题考查氧化还原反应,侧重于学生的分析能力的考查,为高考常见题型和高频考点,注意从元素化合价的角度分析,能用双线桥标出电子转移的方向和数目,难度不大.

练习册系列答案
相关题目
随着化学工业的发展,各种化学合成材料已走进我们寻常百姓家,下列关于生活中常用材料的认识正确的是( )
| A、尼龙、羊毛和棉花都是天然纤维 |
| B、有机玻璃、锦纶、电玉、真丝巾都是合成塑料 |
| C、由酚醛树脂合成的电木,制成的插座破裂后可以热修补 |
| D、装食品用的聚乙烯塑料袋可以通过加热进行封口 |
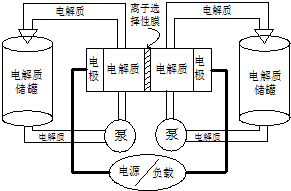 如图是一种正在投入生产的大型蓄电系统.左右两侧为电解质储罐,中央为电池,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;放电前,被膜隔开的电解质为Na2S2(右罐)和NaBr3(左罐),放电后,分别变为Na2S4和NaBr.下列说法正确的是( )
如图是一种正在投入生产的大型蓄电系统.左右两侧为电解质储罐,中央为电池,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;放电前,被膜隔开的电解质为Na2S2(右罐)和NaBr3(左罐),放电后,分别变为Na2S4和NaBr.下列说法正确的是( )| A、电池充电时,阳极电极反应式为:3Br--2e-=Br3- |
| B、电池放电时,负极电极反应式为:2S22-+2e-═S42- |
| C、电池放电时,电池的总反应方程式为:Na2S4+3NaBr=2Na2S2+NaBr3 |
| D、在充电过程中Na+通过膜的流向为从右到左 |
能源危机是制约现代社会发展的严重问题,开发和利用新能源是中国立足自身解决能源困扰的重要举措之一.背景材料:①2005国际油价飙升,新型纳米金属燃料面世;②2006年1月1日,“苏北五市”全面推广使用乙醇汽油;③到2010年,江苏省将打造成为全国最重要的太阳能产业基地;④生物柴油是以油脂为原料,通过水解、酯化所得高级脂肪酸甲酯.下列说法正确的是( )
| A、乙醇汽油的推广使用大大降低了国际市场的原油价格 |
| B、生物柴油燃烧不会产生二氧化碳,是一种清洁能源 |
| C、石油是一种清洁安全的可再生能源 |
| D、纳米金属燃料表面积大,易引发,能量释放快 |
 美国科学家合成了含有N5+的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈“V”形,如图所示.以下有关该物质的说法中正确的是( )
美国科学家合成了含有N5+的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈“V”形,如图所示.以下有关该物质的说法中正确的是( )| A、每个该离子中含有35个质子和36个电子 |
| B、该离子中只含有非极性键 |
| C、该离子中含有2个π键 |
| D、N5+与PCl4+互为等电子体 |
相同体积的NaCl溶液(浓度为C1)和Na2SO4溶液(浓度为C2),若其中的Na+物质的量浓度相同,则它们的物质的量浓度C1和C2的关系是( )
| A、C1>C2 |
| B、C1=C2 |
| C、C1<C2 |
| D、2 C1=C2 |



