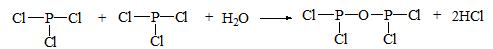题目内容
19.某无色溶液是两种溶质溶解于水形成的浓溶液,其中含有六种离子.为鉴别这两种溶质,进行下列实验:①取少量溶液,加入BaCl2溶液,有白自色沉淀生成;②取少量溶液,逐滴滴加NaOH浓溶液,先出现白色沉淀;然后又无色有刺激性气味的气体生成,用湿润红色石蕊试纸检验,试纸变蓝;最后沉淀逐渐溶解.这两种溶质可能是( )| A. | Al2(SO4)3、(NH4)2SO4 | B. | NaAlO2、NH4Cl | C. | Al2(SO4)3、NH4Cl | D. | AgNO3、(NH4)2SO4 |
分析 由①取少量溶液,加入BaCl2溶液,有白自色沉淀生成,白色沉淀为AgCl或硫酸钡、碳酸钡等;
由②取少量溶液,逐滴滴加NaOH浓溶液,先出现白色沉淀;然后又无色有刺激性气味的气体生成,用湿润红色石蕊试纸检验,试纸变蓝;最后沉淀逐渐溶解,则白色沉淀为氢氧化铝,气体为氨气,原溶液中一定含NH4+、Al3+,以此来解答.
解答 解:由①取少量溶液,加入BaCl2溶液,有白自色沉淀生成,白色沉淀为AgCl或硫酸钡、碳酸钡等;
由②取少量溶液,逐滴滴加NaOH浓溶液,先出现白色沉淀;然后又无色有刺激性气味的气体生成,用湿润红色石蕊试纸检验,试纸变蓝;最后沉淀逐渐溶解,则白色沉淀为氢氧化铝,气体为氨气,原溶液中一定含NH4+、Al3+,
综上所述,原溶液中一定含阳离子为NH4+、Al3+,阴离子一定含SO42-,可能有Cl-,而D中AgNO3、(NH4)2SO4不能共存,
水溶液中均含OH-、H+,结合六种离子可知只有C符合,
故选C.
点评 本题考查无机物的推断,为高频考点,把握常见离子之间的反应、现象推断物质为解答的关键,侧重分析与推断能力的考查,注意阴离子的判断及水溶液中均含OH-、H+,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列目的能达到的是( )
| A. | 将58.5 g NaCl溶于1 L 水中可得1 mol•L-1的NaCl溶液 | |
| B. | 将标准状况下22.4 L HCl溶于1 L 水中可得1 mol•L-1盐酸 | |
| C. | 将25.0 g胆矾溶于水后配成100 mL溶液所得溶液中溶质的物质的量浓度为1 mol•L-1 | |
| D. | 将78 g Na2O2溶于水,配成1 L溶液,其物质的量浓度为1 mol•L-1 |
10.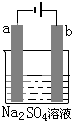 图为直流电源电解1L 0.2mol/L的CuSO4水溶液的装置.通电一段时间后,b电极共收集到4.48L的气体(标准状况下),然后在石墨电极a和b附近分别滴加一滴石蕊试液,下列关于实验的叙述中不正确的是( )
图为直流电源电解1L 0.2mol/L的CuSO4水溶液的装置.通电一段时间后,b电极共收集到4.48L的气体(标准状况下),然后在石墨电极a和b附近分别滴加一滴石蕊试液,下列关于实验的叙述中不正确的是( )
 图为直流电源电解1L 0.2mol/L的CuSO4水溶液的装置.通电一段时间后,b电极共收集到4.48L的气体(标准状况下),然后在石墨电极a和b附近分别滴加一滴石蕊试液,下列关于实验的叙述中不正确的是( )
图为直流电源电解1L 0.2mol/L的CuSO4水溶液的装置.通电一段时间后,b电极共收集到4.48L的气体(标准状况下),然后在石墨电极a和b附近分别滴加一滴石蕊试液,下列关于实验的叙述中不正确的是( )| A. | a电极的产物有Cu和H2 | |
| B. | 反应一段时间后,溶液的pH值变小 | |
| C. | a电极附近呈红色,b电极附近出现蓝色. | |
| D. | a、b电极转移的电子数为0.4mol |
7.化学在工农业生产和日常生活中都有着重要的应用.下列叙述不正确的是( )
| A. | 长期使用(NH4)2SO4化肥会使土壤酸化,而过度使用尿素[CO(NH2)2]会使土壤碱化 | |
| B. | 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去 | |
| C. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 | |
| D. | 神舟10号飞船所用太阳能电池板可将光能转换为电能,所用转换材料是SiO2 |
14.某外控型食品保鲜剂以淀粉、二氧化硅(SiO2)为载体,吸附酒精制作而成.保鲜原理是酒精缓慢挥发,在食品周围形成一定浓度的气体保护层.下列说法不正确的是( )
| A. | SiO2中的Si的化合价为+4 | B. | 起保鲜作用的物质是酒精 | ||
| C. | 该保鲜剂不能与明火接触 | D. | 酒精挥发时分子体积变大 |
4.下列有关实验装置进行的相应实验,能达到实验目的是( )
| A. | 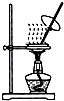 蒸发FeCl3溶液得氯化铁晶体 | |
| B. | 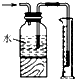 测量氯气的体积 | |
| C. |  作为制取少量SO2的尾气吸收装置 | |
| D. | 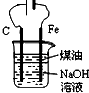 制备Fe(OH)2并能较长时间观察其颜色 |
8.下列有关实验的描述正确的是( )
| A. | 氢氧化钠固体保存在配有橡皮塞的细口瓶中 | |
| B. | 将SO2通入品红溶液或KMnO4溶液均能使它们褪色,均可证明有漂白性 | |
| C. | 不能在石英坩埚中熔化氢氧化钠 | |
| D. | 用湿润的pH试纸测定稀盐酸的pH |