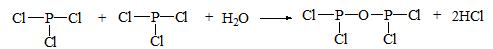题目内容
20.NA表示阿伏伽德罗常数的值,则下列说法正确的是( )| A. | 78gNa2O2固体含有的离子数为4NA | |
| B. | 22.4L乙烯中含有的分子数为NA | |
| C. | 用惰性电极电解NaCl溶液,每生成agNaOH时,电路中通过的电子个数为aNA | |
| D. | 1molSiO2晶体中Si-O键数为4NA |
分析 A.过氧化钠中阴离子为过氧根离子;
B.气体状况未知;
C.依据方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,解答;
D.依据二氧化硅结构解答.
解答 解:A.78gNa2O2固体物质的量为$\frac{78g}{78g/mol}$=1mol,含有2mol钠离子和1mol过氧根离子,共含有的离子数为3NA,故A错误;
B.气体状况未知,Vm未知,无法计算乙烯的物质的量,故B错误;
C.依据方程式可知:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,生成1mol氢氧化钠转移1mol电子,则agNaOH时,电路中通过的电子个数为$\frac{a}{40}$NA,故C错误;
D.二氧化硅晶体中,每个硅原子与4个氧原子结合,所以1molSiO2晶体中Si-O键数为4NA,故D正确;
故选:D.
点评 本题考查了阿伏加德罗常数的有关计算和判断,注意熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件及标况下常见物质的状态,注意二氧化硅晶体结构特点,题目难度中等.

练习册系列答案
相关题目
10.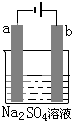 图为直流电源电解1L 0.2mol/L的CuSO4水溶液的装置.通电一段时间后,b电极共收集到4.48L的气体(标准状况下),然后在石墨电极a和b附近分别滴加一滴石蕊试液,下列关于实验的叙述中不正确的是( )
图为直流电源电解1L 0.2mol/L的CuSO4水溶液的装置.通电一段时间后,b电极共收集到4.48L的气体(标准状况下),然后在石墨电极a和b附近分别滴加一滴石蕊试液,下列关于实验的叙述中不正确的是( )
 图为直流电源电解1L 0.2mol/L的CuSO4水溶液的装置.通电一段时间后,b电极共收集到4.48L的气体(标准状况下),然后在石墨电极a和b附近分别滴加一滴石蕊试液,下列关于实验的叙述中不正确的是( )
图为直流电源电解1L 0.2mol/L的CuSO4水溶液的装置.通电一段时间后,b电极共收集到4.48L的气体(标准状况下),然后在石墨电极a和b附近分别滴加一滴石蕊试液,下列关于实验的叙述中不正确的是( )| A. | a电极的产物有Cu和H2 | |
| B. | 反应一段时间后,溶液的pH值变小 | |
| C. | a电极附近呈红色,b电极附近出现蓝色. | |
| D. | a、b电极转移的电子数为0.4mol |
8.下列有关实验的描述正确的是( )
| A. | 氢氧化钠固体保存在配有橡皮塞的细口瓶中 | |
| B. | 将SO2通入品红溶液或KMnO4溶液均能使它们褪色,均可证明有漂白性 | |
| C. | 不能在石英坩埚中熔化氢氧化钠 | |
| D. | 用湿润的pH试纸测定稀盐酸的pH |
12.氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用.
(1)根据下面能量变化示意图(图1),请写出 NO 和 CO2 反应的热化学方程式NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1.

(2)在固定体积的密闭容器中,进行如下化学反应:2NH3(g)?N2(g)+3H2(g)△H>0,其平衡常数 K 与温度 T 的关系如表:
①试判断 K1<K2(填写“>”,“<”或“=”);
②该反应的熵变△S>0 (填“>”,“<”或“=”);
③下列各项能说明该反应已达到平衡状态的是c(填字母);
a.容器内 N2、H2、NH3 的物质的量之比为 1:3:2
b.2v(NH3)正=3v(H2)
c.容器内混合气体平均相对分子质量保持不变
d.混合气体的密度保持不变
④一定温度下,在 1L 密闭容器中充入 1molN2 和 3molH2 并发生反应.若容器容积恒 定,10min 达到平衡时,气体的总物质的量为原来的$\frac{9}{10}$,则 N2 的转化率 α(N2)=20%.
(3)在常温常压下 pH 均等于 5 的 CH3COOH 和 HCl 溶液,两种溶液中由水电离出来的c(H+)之比为1:1.
(4)对反应 N2O4(g)?2NO2(g)△H>0,在温度分别为 T1、T2时,平衡体 系中 NO2 的体积分数随压强变化曲线如图2所示,下列说法正确的是cd.
a.A、C 两点的反应速率:A>C
b.A、C 两点的化学平衡常数:A>C
c.A、C 两点 N2O4 的转化率:A>C
d.由状态 B 到状态 A,可以用加热的方法.
(1)根据下面能量变化示意图(图1),请写出 NO 和 CO2 反应的热化学方程式NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1.

(2)在固定体积的密闭容器中,进行如下化学反应:2NH3(g)?N2(g)+3H2(g)△H>0,其平衡常数 K 与温度 T 的关系如表:
| T/K | 2.98 | 398 | 498 |
| 平衡常数K | 2.44×10-6 | K1 | K2 |
②该反应的熵变△S>0 (填“>”,“<”或“=”);
③下列各项能说明该反应已达到平衡状态的是c(填字母);
a.容器内 N2、H2、NH3 的物质的量之比为 1:3:2
b.2v(NH3)正=3v(H2)
c.容器内混合气体平均相对分子质量保持不变
d.混合气体的密度保持不变
④一定温度下,在 1L 密闭容器中充入 1molN2 和 3molH2 并发生反应.若容器容积恒 定,10min 达到平衡时,气体的总物质的量为原来的$\frac{9}{10}$,则 N2 的转化率 α(N2)=20%.
(3)在常温常压下 pH 均等于 5 的 CH3COOH 和 HCl 溶液,两种溶液中由水电离出来的c(H+)之比为1:1.
(4)对反应 N2O4(g)?2NO2(g)△H>0,在温度分别为 T1、T2时,平衡体 系中 NO2 的体积分数随压强变化曲线如图2所示,下列说法正确的是cd.
a.A、C 两点的反应速率:A>C
b.A、C 两点的化学平衡常数:A>C
c.A、C 两点 N2O4 的转化率:A>C
d.由状态 B 到状态 A,可以用加热的方法.
1.下列离子方程式书写正确是( )
| A. | 硫酸溶液与氢氧化钡溶液反应:Ba2++H++OH-+SO42-═BaSO4↓+H2O | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3NH3•H2O══Al(OH)3↓+3NH4+ | |
| C. | Na与水反应:Na+H2O═Na++OH-+H2↑ | |
| D. | 碳酸钠与氢氧化钠:HCO3-+OH-═CO32-+H2O |