题目内容
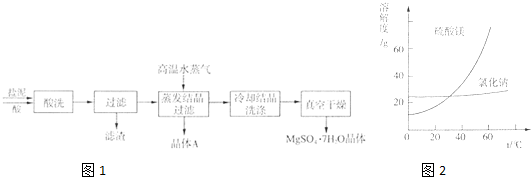
表中是几种弱酸常温下的电离平衡常数:
(1)四种酸的酸性由强到弱的顺序为 .(填编号)
(2)多元弱酸的二级电离程度远小于一级电离的原因是 .
(3)同浓度的CH3COO-、HCO3-、CO32-、S2-结合H+的能力由强到弱的顺序为 .
| ①CH3COOH | ②H2CO3 | ③H2S | ④H4PO4 |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
(2)多元弱酸的二级电离程度远小于一级电离的原因是
(3)同浓度的CH3COO-、HCO3-、CO32-、S2-结合H+的能力由强到弱的顺序为
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:(1)相同条件下,酸的电离平衡常数越大,其酸性越强,多元弱酸的酸性决定于一级电离;
(2)据影响弱电解质的电离平衡移动的因素考虑;
(3)相同条件下,酸的电离平衡常数越小,其越难电离,其酸根越容易结合氢离子.
(2)据影响弱电解质的电离平衡移动的因素考虑;
(3)相同条件下,酸的电离平衡常数越小,其越难电离,其酸根越容易结合氢离子.
解答:
解::(1)相同条件下,酸的电离平衡常数越大,其酸性越强,多元弱酸的酸性决定于一级电离,所以四种酸的酸性④>①>②>③,故答案为:④>①>②>③;(2)多元弱酸一级电离产生的氢离子会抑制二级电离,所以元弱酸的二级电离程度远小于一级电离,故答案为:一级电离产生的氢离子会抑制二级电离;
(3)相同条件下,酸的电离平衡常数越小,其越难电离,其酸根越容易结合氢离子,所以同浓度的CH3COO-、HCO3-、CO32-、S2-结合H+的能力由强到弱的顺序为S2-、CO32-、HCO3-、CH3COO-,故答案为:S2-、CO32-、HCO3-、CH3COO-.
(3)相同条件下,酸的电离平衡常数越小,其越难电离,其酸根越容易结合氢离子,所以同浓度的CH3COO-、HCO3-、CO32-、S2-结合H+的能力由强到弱的顺序为S2-、CO32-、HCO3-、CH3COO-,故答案为:S2-、CO32-、HCO3-、CH3COO-.
点评:本题考查了弱电解质的电离,明确电离平衡常数与酸或碱性强弱的关系是解本题关键,题目难度中等.

练习册系列答案
相关题目
美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是( )
| A、合金的熔点一般比组分金属低 |
| B、铝钠合金若投入一定量的水中可得无色溶液,则n(Al)≤n(Na) |
| C、铝钠合金投入到足量氯化铜溶液中,会有氢氧化铜沉淀也可能有铜析出 |
| D、若m g不同组成的铝钠合金投入足量盐酸中,放出的H2越多,则铝的质量分数越小 |
将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系.下列判断正确的是( )
| A、若反应中转移的电子为nmol,则0.15<n<0.25 |
| B、n(Na+):n(Cl-)可能为7:3 |
| C、与NaOH反应的氯气一定为0.3mol |
| D、n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1 |
地壳中含量最多的金属元素是( )
| A、O | B、Al | C、Fe | D、Cu |
下列离子方程式正确的是( )
| A、0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3?H2O | ||||
| B、100ml 0.1mol/L FeI2溶液与标况下0.224L Cl2:2Fe2++Cl2═2Fe3++2Cl- | ||||
C、NH4HCO3溶液与过量NaOH溶液共热:NH4++OH-
| ||||
D、浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+
|
 现有8种元素,它们的原子序数依次增大,其中A、B、C、D、E为短周期主族元素,F、G、H为第四周期元素.请根据下列相关信息,回答问题.
现有8种元素,它们的原子序数依次增大,其中A、B、C、D、E为短周期主族元素,F、G、H为第四周期元素.请根据下列相关信息,回答问题.
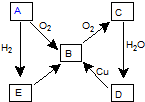 图表示某气态单质A及其化合物之间的转化关系 (某些产物和反应条件已略去).
图表示某气态单质A及其化合物之间的转化关系 (某些产物和反应条件已略去).