题目内容
下列离子方程式正确的是( )
| A、0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3?H2O | ||||
| B、100ml 0.1mol/L FeI2溶液与标况下0.224L Cl2:2Fe2++Cl2═2Fe3++2Cl- | ||||
C、NH4HCO3溶液与过量NaOH溶液共热:NH4++OH-
| ||||
D、浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+
|
考点:离子方程式的书写
专题:离子反应专题
分析:A.等体积混合,物质的量比为1:2,反应生成硫酸钡、一水合氨、氢氧化铝;
B.物质的量相等,由电子守恒及优先氧化可知,只有碘离子被氧化;
C.漏写碳酸氢根离子与碱的反应;
D.反应生成硝酸亚铁.
B.物质的量相等,由电子守恒及优先氧化可知,只有碘离子被氧化;
C.漏写碳酸氢根离子与碱的反应;
D.反应生成硝酸亚铁.
解答:
解:A.0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合的离子反应为NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3?H2O,故A正确;
B.100ml 0.1mol/L FeI2溶液与标况下0.224L Cl2的离子反应为2I-+Cl2═I2+2Cl-,故B错误;
C.NH4HCO3溶液与过量NaOH溶液共热的离子反应为HCO3-+NH4++OH-
NH3↑+2H2O+CO32-,故C错误;
D.浓硝酸中加入过量铁粉并加热的离子反应为Fe+2NO3-+4H+
Fe2++2NO2↑+2H2O,故D错误;
故选A.
B.100ml 0.1mol/L FeI2溶液与标况下0.224L Cl2的离子反应为2I-+Cl2═I2+2Cl-,故B错误;
C.NH4HCO3溶液与过量NaOH溶液共热的离子反应为HCO3-+NH4++OH-
| ||
D.浓硝酸中加入过量铁粉并加热的离子反应为Fe+2NO3-+4H+
| ||
故选A.
点评:本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重与量有关的离子反应及氧化还原反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
25℃时,0.01mol?L-1 的H2SO4溶液中,由水电离出的c(H+)是( )
| A、0.01 mol?L-1 |
| B、0.02 mol?L-1 |
| C、1×10-12 mol?L-1 |
| D、5×10-13 mol?L-1 |
联苯的结构简式: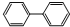 ,下列有关联苯的说法中正确的是( )
,下列有关联苯的说法中正确的是( )
 ,下列有关联苯的说法中正确的是( )
,下列有关联苯的说法中正确的是( )| A、分子中含有6个碳碳双键 |
| B、联苯的一硝基取代产物的3种 |
| C、它容易发生加成反应、取代反应,容易被强氧化剂氧化 |
D、它和蒽(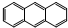 )同属于芳香烃,两者互为同系物 )同属于芳香烃,两者互为同系物 |
使反应4NH3(g)+3O2(g)=2N2(g)+6H2O(g)在2L的密闭容器中进行,半分钟后N2的物质的量增加了0.6mol.此反应的平均速率v(X)为( )
| A、v (NH3)=0.05mol?L-1?s-1 |
| B、v(O2)=0.015mol?L-1.s-1 |
| C、v(N2)=0.02mol?L-1?s-1 |
| D、v(H2O)=0.02mol?L-1?S-1 |
下列反应中属于加成反应的是( )
| A、乙烷与氯气在光照条件下的反应 |
| B、乙烯使酸性高锰酸钾溶液褪色 |
| C、己烷与溴水混合振荡,静置后溴水层褪色 |
| D、在催化剂作用下,乙烯和水反应生成乙醇 |
A、B、C三种物质的化学式相同,但结构不同,它们之间的转化如下所示:1molA
1molB
1molC,已知:a>b,下列说法正确的是( )
| 吸收akJ能量 |
| 放出bkJ能量 |
| A、A-C是放热反应 |
| B、A-C的△H的大小与A、B、C的聚集状态无关 |
| C、A-B一定没有化学键的断裂 |
| D、物质A比物质C更稳定 |
短周期元素A、B、C的原子序数依次递增,它们的原子最外层电子数之和为10,A和C同主族,B原子的最外层电子数等于A原子的次外层电子数,下列叙述中正确的是( )
| A、原子半径:A<B<C |
| B、C的最简单氢化物的稳定性大于A的最简单氢化物的稳定性 |
| C、高温下,A单质能置换出C单质 |
| D、三种元素的最高价氧化物对应的水化物均可由化合反应得到 |