题目内容
10.反应 PCl5(g)?PCl3(g)+Cl2(g) ①2HI(g)?H2(g)+I2(g)②在一定条件下,达到化学平衡时,反应物的转化率均是 a%.若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率( )| A. | 均增大 | B. | 均不变 | C. | ①增大,②不变 | D. | ①减小,②不变 |
分析 温度、体积不变时,加反应物,由pV=nRT可知,n增大,压强增大,结合①为气体体积增大的反应、②为气体体积不变的反应来解答.
解答 解:温度、体积不变时,加反应物,由pV=nRT可知,n增大,压强增大,
对于PCl5(g)?PCl3(g)+Cl2(g) ①,增大压强,平衡逆向移动,转化率减小;
对于2HI(g)?H2(g)+I2(g)②,增大压强,平衡不移动,转化率不变,
故选D.
点评 本题考查化学平衡移动,为高频考点,把握压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意反应方程式的特点,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.下列说法正确的是( )
| A. | 导电性强的溶液一定是强电解质溶液 | |
| B. | H2SO4是强电解质,稀硫酸中没有H2SO4分子 | |
| C. | NaCl晶体是由Na+和Cl-组成,NaCl晶体是良导体 | |
| D. | 氯气和氨气的水溶液导电性都很好,所以它们是强电解质 |
1.反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O.下列叙述不正确的是( )
| A. | 氧化剂为KMnO4,其中Cl元素被还原 | |
| B. | 若有0.8molH2O生成,则反应中有NA个电子转移 | |
| C. | 浓HCl在反应中起酸性和还原性的作用 | |
| D. | 由此反应可以大胆推测氧化性强弱关系:KMnO4>MnO2 |
5.下列化合物中,能通过单质与酸反应或单质间化合直接制取的是( )
| A. | CuCl2 | B. | FeCl2 | C. | AlCl3 | D. | FeCl3 |
2.下列事实与共价键的强弱有关的是( )
| A. | HF的沸点高于HCl | B. | 金刚石的熔点比晶体硅高 | ||
| C. | 稀有气体一般很难发生化学反应 | D. | 常温下单质溴呈液态、碘呈固态 |
15.1mol氨气(化学式为:NH3)分解成氮气和氢气要吸收46.19kJ的热量,下列热化学方程式中正确的是( )
| A. | 2NH3=N2+3H2-46.19kJ | B. | 2NH3(g)=N2(g)+3H2(g)-46.19kJ | ||
| C. | NH3(g)=$\frac{1}{2}{N_2}$(g)+$\frac{3}{2}{H_2}$(g)-46.19kJ | D. | 2NH3(g)=N2(g)+3H2(g)+92.38kJ |
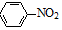 +4Mg+8CH3OH→
+4Mg+8CH3OH→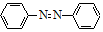 +4Mg(OCH3)2+4H2O
+4Mg(OCH3)2+4H2O